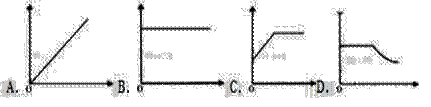2020дәәж•ҷзүҲеҲқдёӯеҢ–еӯҰдё“йўҳз»ғд№
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ғзҙ и§ӮжҳҜеҢ–еӯҰзҡ„йҮҚиҰҒи§Ӯеҝөд№ӢдёҖгҖӮдёӢеҲ—жңүе…іе…ғзҙ зҡ„иҜҙжі•дёӯй”ҷиҜҜзҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺ е…ғзҙ жҳҜе…·жңүзӣёеҗҢж ёз”өиҚ·ж•°зҡ„дёҖзұ»еҺҹеӯҗзҡ„жҖ»з§° BпјҺ е…ғзҙ е‘ЁжңҹиЎЁдёӯпјҢе…ғзҙ зҡ„еҺҹеӯҗеәҸж•°дёҺиҜҘе…ғзҙ еҺҹеӯҗж ёз”өиҚ·ж•°еңЁж•°еҖјдёҠзӣёеҗҢ CпјҺ еҗҢз§Қе…ғзҙ зҡ„еҺҹеӯҗж ёеҶ…иҙЁеӯҗж•°дёҺдёӯеӯҗж•°дёҖе®ҡзӣёзӯү DпјҺ еңЁзү©иҙЁеҸ‘з”ҹеҢ–еӯҰеҸҳеҢ–ж—¶пјҢеҺҹеӯҗзҡ„з§Қзұ»дёҚеҸҳпјҢе…ғзҙ д№ҹдёҚдјҡж”№еҸҳ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗзәҜеҮҖзү©XеңЁз©әж°”дёӯе®Ңе…ЁзҮғзғ§пјҢеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡX+2O2 AпјҺ Xз”ұзўігҖҒж°ўгҖҒж°§дёүз§Қе…ғзҙ з»„жҲҗ BпјҺ Xзҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёә10 CпјҺ XдёӯзўігҖҒж°ўе…ғзҙ зҡ„иҙЁйҮҸжҜ”дёә1пјҡ4 DпјҺ XеұһдәҺжңүжңәеҢ–еҗҲзү©
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
й•ҒеёҰеңЁеҜҶй—ӯе®№еҷЁпјҲеҶ…еҗ«з©әж°”пјүдёӯеҠ зғӯпјҢдёӢеӣҫпјҲжЁӘеқҗж ҮиЎЁзӨәжҖ»иҙЁйҮҸпјҢзәөеқҗж ҮиЎЁзӨәж—¶й—ҙпјүиғҪжӯЈзЎ®иЎЁзӨәе®№еҷЁжүҖзӣӣзү©иҙЁжҖ»иҙЁйҮҸеҸҳеҢ–зҡ„жҳҜпјҲ пјү
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
ж №жҚ®иҙЁйҮҸе®ҲжҒ’е®ҡеҫӢпјҢ2gж°ўж°”е’Ң8gж°§ж°”е……еҲҶзҮғзғ§еҸҜз”ҹжҲҗж°ҙпјҲВ пјү AпјҺ 10gВ В В В BпјҺ 9gВ В В В CпјҺ 8.5gВ В В В DпјҺ жқЎд»¶дёҚи¶іпјҢж— жі•зЎ®е®ҡ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺS+O2=SO2зҡ„зҗҶи§ЈдёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү AпјҺ иЎЁзӨәзЎ«дёҺж°§ж°”еңЁзӮ№зҮғжқЎд»¶дёӢеҸҚеә”з”ҹжҲҗдәҢж°§еҢ–зЎ« BпјҺ еҸӮеҠ еҸҚеә”зҡ„зЎ«дёҺж°§ж°”зҡ„иҙЁйҮҸжҜ”жҳҜ2:1 CпјҺ еҸҚеә”еүҚеҗҺзЎ«еҺҹеӯҗгҖҒж°§еҺҹеӯҗзҡ„дёӘж•°еқҮдёҚеҸҳ DпјҺ еҸӮеҠ еҸҚеә”зҡ„ж°§ж°”дёҺз”ҹжҲҗзҡ„дәҢж°§еҢ–зЎ«зҡ„еҲҶеӯҗдёӘж•°жҜ”дёә1:1
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
д»Һз”өи§Јж°ҙеҸҚеә”зҡ„еҫ®и§ӮзӨәж„ҸеӣҫдёӯиҺ·еҫ—зҡ„дҝЎжҒҜжӯЈзЎ®зҡ„жҳҜпјҲ пјү
AпјҺ еҢ–еӯҰеҸҚеә”жҳҜеҲҶеӯҗзҡ„йҮҚж–°з»„еҗҲ BпјҺ еҢ–еӯҰеҸҚеә”еүҚеҗҺеҺҹеӯҗзҡ„ж•°зӣ®еўһеӨҡ CпјҺ иҜҘеҸҚеә”зҡ„еҸҚеә”зұ»еһӢдёәеҲҶи§ЈеҸҚеә” DпјҺ иҜҘеҸҚеә”иҜҙжҳҺж°ҙз”ұж°ўж°”е’Ңж°§ж°”з»„жҲҗ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
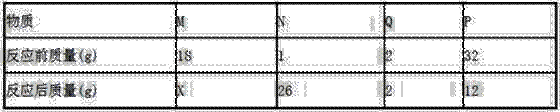
еңЁдёҖдёӘеҜҶй—ӯе®№еҷЁдёӯж”ҫе…ҘMгҖҒNгҖҒQгҖҒPеӣӣз§Қзү©иҙЁпјҢеңЁдёҖе®ҡжқЎд»¶дёӢеҸ‘з”ҹеҢ–еӯҰеҸҚеә”пјҢдёҖж®өж—¶й—ҙеҗҺпјҢжөӢеҫ—жңүе…іж•°жҚ®еҰӮдёӢиЎЁпјҢеҲҷе…ідәҺжӯӨеҸҚеә”и®ӨиҜҶдёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү
AпјҺ иҜҘеҸҳеҢ–зҡ„еҹәжң¬еҸҚеә”зұ»еһӢжҳҜеҲҶи§ЈеҸҚеә” BпјҺ еҸҚеә”еҗҺзү©иҙЁMзҡ„иҙЁйҮҸдёәl3g CпјҺ еҸҚеә”дёӯNгҖҒPзҡ„иҙЁйҮҸжҜ”дёә5пјҡ4 DпјҺ зү©иҙЁQеҸҜиғҪжҳҜиҜҘеҸҚеә”зҡ„еӮ¬еҢ–еүӮ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еӯҰж–№зЁӢејҸдёӯз¬ҰеҗҲйўҳж„Ҹдё”д№ҰеҶҷжӯЈзЎ®зҡ„жҳҜпјҲ пјү AпјҺ жӯЈеёёйӣЁж°ҙеҒҸејұй…ёжҖ§еҺҹеӣ пјҡSO2+H2Oв•җH2SO4 BпјҺ з”ҹжҙ»дёӯз”ЁеӨ©з„¶ж°”дҪңзҮғж–ҷпјҡC2H3OH+3O2 CпјҺ з”Ёе°ҸиӢҸжү“жІ»з–—иғғй…ёиҝҮеӨҡз—ҮпјҡNaHCO3+HClв•җNaCl+CO2вҶ‘+H2O DпјҺ е·ҘдёҡдёҠз”ЁзҶҹзҹізҒ°еҲ¶еҸ–зғ§зўұпјҡCa(OH)2+2NaNO3в•җCa(NO3)2+2NaOH
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еӯҰж–№зЁӢејҸдёӯз¬ҰеҗҲйўҳж„Ҹдё”д№ҰеҶҷжӯЈзЎ®зҡ„жҳҜпјҲВ пјү AпјҺ еҶӣдәӢдёҠеҲ©з”Ёй•ҒдҪңзҮғзғ§еј№пјҡ Mg+O2 BпјҺ з”ҹжҙ»дёӯеҲ©з”Ёж°ўж°”дҪңзҮғж–ҷпјҡ H2+O2 CпјҺ еҸӨд»ЈеҲ©з”Ёж№ҝй“ҒзӮјй“ңжі•еҲ¶й“ңпјҡFe+CuSO4в•җCuвҶ“+FeSO4 DпјҺ е·ҘдёҡдёҠз”ЁзҹізҒ°зҹіеҲ¶з”ҹзҹізҒ°пјҡCaCO3CO2вҶ‘пјӢCaO
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ідәҺеҢ–еӯҰж–№зЁӢејҸзҡ„ж„Ҹд№үзҡ„иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺ иЎЁзӨәеҗ„зү©иҙЁд№Ӣй—ҙзҡ„иҙЁйҮҸжҜ” BпјҺ иЎЁжҳҺдәҶеҸҚеә”зҡ„жқЎд»¶ CпјҺ иЎЁжҳҺдәҶеҸҚеә”зҡ„йҖҹзҺҮ DпјҺ иЎЁжҳҺеҢ–еӯҰеҸҚеә”зҡ„еҸҚеә”зү©гҖҒз”ҹжҲҗзү©
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүAгҖҒBгҖҒCдёүз§Қзү©иҙЁеҗ„16gж··еҗҲеҠ зғӯпјҢе……еҲҶеҸҚеә”еҗҺж··еҗҲзү©дёӯиҝҳжңү12gAгҖҒ27gCе’ҢдёҖе®ҡиҙЁйҮҸзҡ„DгҖӮе·ІзҹҘBе®Ңе…ЁеҸҚеә”пјҢиӢҘAгҖҒBгҖҒCгҖҒDзҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёә16гҖҒ32гҖҒ44гҖҒ18пјҢеҲҷиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸеҸҜиЎЁзӨәдёәпјҲ пјү AпјҺ 2A+B=C+2D BпјҺ A+2B=C+2D CпјҺ 2A+B=2C+D DпјҺ A+B=C+D
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дәәеңЁеү§зғҲиҝҗеҠЁеҗҺпјҢиЎҖж¶Ідёӯдјҡдә§з”ҹиҫғеӨҡзҡ„д№ій…ё(еҢ–еӯҰејҸдёәC3H6O3)пјҢдҪҝиӮҢиӮүй…ёз—ӣпјҺж”ҫжқҫдёҖж®өж—¶й—ҙеҗҺпјҢз”ұдәҺд№ій…ёдёҺеҗёе…Ҙзҡ„ж°§ж°”еҸҚеә”з”ҹжҲҗдәҢж°§еҢ–зўіе’Ңж°ҙпјҢиҖҢдҪҝиӮҢиӮүзҡ„й…ёз—ӣж„ҹж¶ҲеӨұгҖӮиЎЁзӨәиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜпјҲ пјү AпјҺ C3H6O3+3O2=3CO2+3H2O BпјҺ C3H6O3+O2=CO2+H2O CпјҺ C3H6O3+3O2=3CO2вҶ‘+3H2O DпјҺ 2C3H6O3+5O2=6CO2+6H2O
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗзү©иҙЁRе®Ңе…ЁзҮғзғ§зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡR+3O2 жңүе…іиҜҘеҸҚеә”пјҢжңүдёӢеҲ—иҜҙжі•пјҡ в‘ RдёҖе®ҡз”ұзўігҖҒж°ўгҖҒж°§дёүз§Қе…ғзҙ з»„жҲҗ в‘ЎRдёҖе®ҡз”ұзўігҖҒж°ўдёӨз§Қе…ғзҙ з»„жҲҗпјҢеҸҜиғҪеҗ«жңүж°§е…ғзҙ в‘ўRдёӯж°ўе…ғзҙ зҡ„иҙЁйҮҸеҲҶж•°жҳҜжңҖе°Ҹ в‘ЈRзҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸзӯүдәҺ46 в‘ӨиӢҘ4.6 g Rе®Ңе…ЁзҮғзғ§з”ҹжҲҗ8.8 g CO2пјҢеҗҢж—¶иҝҳз”ҹжҲҗдәҶ5.4 g H2O е…¶дёӯжӯЈзЎ®иҜҙжі•зҡ„дёӘж•°жңүпјҲ пјү AпјҺ 2дёӘВ В В BпјҺ 3дёӘВ В CпјҺ 4дёӘВ В В DпјҺ 5дёӘ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁвҖң2A+3B=2C+4DвҖқзҡ„еҸҚеә”дёӯпјҢе·ІзҹҘ8gзү©иҙЁAе®Ңе…ЁеҸҚеә”з”ҹжҲҗ11gзү©иҙЁCе’Ң9gзү©иҙЁDгҖӮиӢҘAзҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёә32пјҢеҲҷзү©иҙЁBзҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸпјҲгҖҖгҖҖпјү AпјҺ 16В В В В BпјҺ 32В В В CпјҺ 48В В В DпјҺ 64
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
3gзўіе’Ң8gж°§ж°”еҸҚеә”з”ҹжҲҗ11gдәҢж°§еҢ–зўіпјҢеҲҷ6gзўіе’Ң8gж°§ж°”еңЁзӮ№зҮғзҡ„жқЎд»¶дёӢе®Ңе…ЁеҸҚеә”з”ҹжҲҗCO2пјҢз”ҹжҲҗCO2зҡ„иҙЁйҮҸдёәпјҲ пјү AпјҺ 14gВ В BпјҺ 11gВ В В CпјҺ 7gВ В В DпјҺ 10g
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁз…ӨдёӯжҺәйҖӮйҮҸзҹізҒ°зҹіпјҢзҮғзғ§ж—¶иғҪеҮҸе°‘SO2зҡ„жҺ’ж”ҫпјҢе…¶еҺҹеӣ жҳҜпјҡ пјҲ1пјү2CaCO3+O2+2SO2=2CaSO4+2XпјҢиҜ·дҪ жҺЁж–ӯXзҡ„еҢ–еӯҰејҸдёә______пјӣпјҲ2пјүжұҪжІ№е®Ңе…ЁзҮғзғ§зҡ„дә§зү©жҳҜж°ҙе’ҢдәҢж°§еҢ–зўіпјҢз”ұжӯӨеҸҜжҺЁж–ӯжұҪжІ№зҡ„з»„жҲҗе…ғзҙ дёӯдёҖе®ҡеҗ«жңүзҡ„е…ғзҙ жҳҜ______пјӣ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ зәізұіжқҗж–ҷе…·жңүзү№ж®Ҡзҡ„жҖ§иҙЁе’ҢеҠҹиғҪгҖӮзәізұіеӣӣж°§еҢ–дёүй“Ғе…·жңүзұ»дјјдәәе·ҘжЁЎжӢҹй…¶зҡ„еӮ¬еҢ–жҖ§иғҪгҖӮ пјҲ1пјүеӣӣж°§еҢ–дёүй“ҒеұһдәҺ____________пјҲеЎ«вҖңж— жңәзү©вҖқжҲ–вҖңжңүжңәзү©вҖқпјүгҖӮ пјҲ2пјүзәізұіеӣӣж°§еҢ–дёүй“ҒиғҪе°ҶиҝҮж°§еҢ–ж°ўеӮ¬еҢ–еҲҶи§Јдёәж°ҙе’Ңж°§ж°”пјҢиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә________гҖӮ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
зЎ«жҳҜдёҖз§ҚжҜ”иҫғжҙ»жіјзҡ„йқһйҮ‘еұһе…ғзҙ пјҢзЎ’пјҲSeпјүзҡ„еҢ–еӯҰжҖ§иҙЁдёҺзЎ«зӣёдјјгҖӮеңЁеҠ зғӯжқЎд»¶дёӢпјҢзЎ«еҸҜдёҺNaOHжә¶ж¶ІеҸҚеә”з”ҹжҲҗзЎ«еҢ–й’ пјҲNa2SпјүгҖҒдәҡзЎ«й…ёй’ пјҲNa2SO3пјүе’Ңж°ҙпјҢзЎ’д№ҹиғҪдёҺNaOHжә¶ж¶ІеҸ‘з”ҹзұ»дјјеҸҚеә”гҖӮиҜ·еҶҷеҮәеңЁеҠ зғӯжқЎд»¶дёӢзЎ’дёҺNaOHжә¶ж¶ІеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ_______________
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁвҖңиҙЁйҮҸе®ҲжҒ’е®ҡеҫӢвҖқзҡ„иҜҫе Ӯж•ҷеӯҰдёӯпјҢиҖҒеёҲеј•еҜјеҗҢеӯҰ们иҝӣиЎҢвҖңеҢ–еӯҰеҸҚеә”дёӯпјҢеҸҚеә”зү©дёҺз”ҹжҲҗзү©зҡ„иҙЁйҮҸе…ізі»вҖқзҡ„е®һйӘҢжҺўз©¶пјҺ他们дҪҝз”Ёзҡ„е®һйӘҢиЈ…зҪ®е’ҢйҖүз”ЁиҚҜе“ҒеҰӮеӣҫжүҖзӨәпјҢзҺ°еҲҶеҲ«д»ҘAгҖҒBгҖҒCгҖҒDиЎЁзӨәеҰӮдёӢпјҡ
AгҖҒBгҖҒCгҖҒDеӣӣдёӘе®һйӘҢеҲҶеҲ«з”ұз”ІгҖҒд№ҷгҖҒдёҷгҖҒдёҒеӣӣдёӘз»„зҡ„еҗҢеӯҰжқҘе®ҢжҲҗпјҢ他们йғҪиҝӣиЎҢдәҶ规иҢғзҡ„ж“ҚдҪңгҖҒеҮҶзЎ®зҡ„з§°йҮҸе’Ңз»ҶиҮҙзҡ„и§ӮеҜҹгҖӮ пјҲ1пјүAе®һйӘҢпјҡй”ҘеҪўз“¶еә•ж”ҫеұӮз»ҶжІҷзҡ„еҺҹеӣ жҳҜпјҡ______пјӣе°Ҹж°”зҗғзҡ„дҪңз”ЁжҳҜпјҡ______пјӣзҷҪзЈ·еҲҡеј•зҮғпјҢз«ӢеҚіе°Ҷй”ҘеҪўз“¶ж”ҫеҲ°еӨ©е№ідёҠз§°йҮҸпјҢеӨ©е№ідёҚе№іиЎЎгҖӮз»“и®әжҳҜпјҡиҙЁйҮҸдёҚе®ҲжҒ’гҖӮеҫ…й”ҘеҪўз“¶еҶ·еҚҙеҗҺпјҢйҮҚж–°ж”ҫеҲ°жүҳзӣҳеӨ©е№ідёҠз§°йҮҸпјҢеӨ©е№іе№іиЎЎгҖӮз»“и®әжҳҜпјҡиҙЁйҮҸе®ҲжҒ’пјҺдҪ и®Өдёәз»“и®әжӯЈзЎ®зҡ„жҳҜ______пјҲеЎ«вҖңеүҚдёҖз§ҚвҖқжҲ–вҖңеҗҺдёҖз§ҚвҖқпјүпјҢиҖҢеҜјиҮҙеҸҰдёҖз§Қз»“и®әй”ҷиҜҜзҡ„еҺҹеӣ жҳҜпјҡ______гҖӮ пјҲ2пјүдёҷз»„еҗҢеӯҰи®ӨдёәCе®һйӘҢиҜҙжҳҺдәҶиҙЁйҮҸе®ҲжҒ’е®ҡеҫӢгҖӮиҜ·дҪ д»ҺеҺҹеӯҗзҡ„и§’еәҰиҜҙжҳҺдёәд»Җд№Ҳпјҹ______пјҺ пјҲ3пјүеҰӮжһңAиЈ…зҪ®дёӯеҸӘжҳҜе°ҶиҚҜе“Ғж”№дёәе°‘йҮҸзҡ„дәҢж°§еҢ–й”°е’ҢиҝҮж°§еҢ–ж°ўпјҢеҸҚеә”еүҚеҗҺеӨ©е№ід»ҚдёҚе№іиЎЎпјҢеҺҹеӣ жҳҜпјҡ______пјӣз»“и®әжҳҜпјҡ______пјӣеҸӮеҠ еҸҚеә”зҡ„иҝҮж°§еҢ–ж°ўзҡ„иҙЁйҮҸдёҖе®ҡ______пјҲеЎ«вҖңзӯүдәҺвҖқжҲ–вҖңдёҚзӯүдәҺвҖқпјүз”ҹжҲҗзҡ„ж°ҙе’Ңж°§ж°”зҡ„иҙЁйҮҸжҖ»е’ҢгҖӮ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁз”ЁзҷҪзЈ·пјҲзҷҪзЈ·дёҺзәўзЈ·з»„жҲҗзӣёеҗҢпјҢзқҖзҒ«зӮ№дёә40в„ғпјүжҺўз©¶иҙЁйҮҸе®ҲжҒ’е®ҡеҫӢзҡ„е®һйӘҢдёӯпјҢе°ҸжҳҺеҗҢеӯҰеҲ©з”ЁеҚ•еӯ”ж©Ўиғ¶еЎһеЎһдёҠз»ҶзҺ»з’ғз®ЎпјҢз»ҶзҺ»з’ғз®ЎдёҠз«Ҝз”Ёж°”зҗғеҜҶе°ҒпјҢе°ҶиЈ…зҪ®ж”ҫеңЁеӨ©е№ідёҠз§°йҮҸжҖ»иҙЁйҮҸдёәM1,е°Ҷй”ҘеҪўз“¶еҸ–дёӢпјҢеҸ–еҮәз»ҶзҺ»з’ғз®ЎпјҢдёӢз«Ҝж”ҫеңЁй…’зІҫзҒҜзҒ«з„°дёҠзҒјзғ§иҮізәўзғӯеҗҺпјҢиҝ…йҖҹз”Ёж©Ўзҡ®еЎһе°Ҷй”ҘеҪўз“¶еЎһзҙ§пјҢ并引зҮғзҷҪзЈ·пјҢе®һйӘҢиҝҮзЁӢеҰӮдёӢеӣҫжүҖзӨәпјҢиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүе®һйӘҢи§ӮеҜҹеҲ°AгҖҒCдёӯж°”зҗғзҡ„еӨ§е°ҸдёҚеҗҢпјҢз”ЁзҗҶеҢ–зҹҘиҜҶи§ЈйҮҠдә§з”ҹжӯӨзҺ°иұЎзҡ„еҺҹеӣ ______пјӣ пјҲ2пјүзҷҪзЈ·зҮғзғ§иҝҮзЁӢдёӯпјҢиғҪи§ӮеҜҹеҲ°зҡ„зҺ°иұЎжҳҜ__________________________________пјӣ пјҲ3пјүе°ҸжҳҺжғіеҲ©з”ЁиҜҘиЈ…зҪ®йӘҢиҜҒиҙЁйҮҸе®ҲжҒ’е®ҡеҫӢпјҢиҝҳйңҖиҰҒиҝӣиЎҢзҡ„ж“ҚдҪңжҳҜ_____________________пјӣ пјҲ4пјүе°ҶCеҶҚж¬Ўж”ҫеҲ°еӨ©е№ідёҠз§°йҮҸпјҢеӨ©е№ід»Қ然平衡пјҢеңЁжӯӨеҢ–еӯҰеҸҚеә”дёӯпјҢд»Һеҫ®и§Ӯи§’еәҰеҲҶжһҗеӨ©е№іе№іиЎЎзҡ„еҺҹеӣ _____________________пјӣ
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
ж—©еңЁ17дё–зәӘпјҢиҙЁйҮҸе®ҲжҒ’е®ҡеҫӢиў«еҸ‘зҺ°д№ӢеүҚпјҢиӢұеӣҪеҢ–еӯҰ家波д№үе°”жӣҫеҒҡиҝҮдёҖдёӘе®һйӘҢпјҡеңЁеҜҶй—ӯзҡ„зҺ»з’ғе®№еҷЁдёӯзҮғзғ§йҮ‘еұһж—¶пјҢеҫ—еҲ°дәҶйҮ‘еұһзҒ°пјҢ然еҗҺз§°йҮҸйҮ‘еұһзҒ°зҡ„иҙЁйҮҸпјҢеҸ‘зҺ°жҜ”еҺҹйҮ‘еұһиҙЁйҮҸеўһеҠ дәҶгҖӮ пјҲ1пјүиҜ•и§ЈйҮҠйҮ‘еұһзҒ°иҙЁйҮҸжҜ”еҺҹйҮ‘еұһиҙЁйҮҸеўһеҠ зҡ„еҺҹеӣ гҖӮ пјҲ2пјүз”ұдәҺжіўд№үе°”з§°йҮҸж–№жі•дёҠзҡ„еҺҹеӣ пјҢд»–й”ҷиҝҮдәҶеҸ‘зҺ°иҙЁйҮҸжҒ’е®ҡзҡ„жңәдјҡгҖӮиҜ·дҪ ж”№иҝӣд»–зҡ„з§°йҮҸж–№жі•пјҢд»ҘйӘҢиҜҒиҙЁйҮҸе®ҲжҒ’е®ҡеҫӢгҖӮ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
й«ҳжё©з……зғ§иҙқеЈіпјҲдё»иҰҒжҲҗеҲҶжҳҜзўій…ёй’ҷпјүеҸҜд»Ҙз”ҹжҲҗж°§еҢ–й’ҷе’ҢдәҢж°§еҢ–зўігҖӮзҺ°жңү10tиҙқеЈіз……зғ§еҗҺиҙЁйҮҸеҮҸе°‘дәҶ2.2tпјҢеҸҜеҲ¶еҫ—ж°§еҢ–й’ҷзҡ„иҙЁйҮҸжҳҜеӨҡе°‘пјҹпјҲеҒҮи®ҫе…¶е®ғжҲҗеҲҶдёҚеҸӮеҠ еҸҚеә”пјү
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ҘдёҡдёҠз……зғ§зҹізҒ°зҹіпјҲCaCO3пјүеҸҜеҲ¶еҫ—з”ҹзҹізҒ°пјҲCaOпјүе’ҢдәҢж°§еҢ–зўіпјҢеҰӮжһңиҰҒеҲ¶еҸ–2.8tж°§еҢ–й’ҷпјҢи®Ўз®—йңҖиҰҒзўій…ёй’ҷзҡ„иҙЁйҮҸгҖӮ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
еҸӨд»Јж№ҝжі•зӮјй“ңзҡ„еҸҚеә”еҺҹзҗҶжҳҜпјҡFe+CuSO4= FeSO4+Cu,иӢҘеҫ—еҲ°16kgзҡ„й“ңпјҢзҗҶи®әдёҠйңҖиҰҒй“ҒиҙЁйҮҸжҳҜеӨҡе°‘пјҹ
|
|
- 2017-2018е№ҙд№қе№ҙзә§дёҠеҶҢеҢ–еӯҰжңҹдёӯиҖғиҜ•иҖғйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲжұҹиҘҝзңҒдё°еҹҺеёӮпјү
- 2019еұҠеҲқдёүдёҠжңҹ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲжұҹиӢҸзңҒжү¬е·һеёӮз«№иҘҝдёӯеӯҰпјү
- жё…иҝңзҹіи§’дёӯеӯҰ2019е№ҙд№қе№ҙзә§дёҠжңҹеҢ–еӯҰжңҲиҖғжөӢйӘҢзҪ‘дёҠиҖғиҜ•з»ғд№
- жІіеҚ—зңҒж°ёеҹҺеёӮйҫҷеІ—дёӯеӯҰдәәж•ҷзүҲд№қе№ҙзә§еҢ–еӯҰдёӢеҶҢдә’еҠЁи®ӯз»ғпјҡ第еҚҒдәҢеҚ•е…ғиҜҫйўҳ1гҖҠдәәзұ»йҮҚиҰҒзҡ„иҗҘе…»зү©иҙЁгҖӢ
- жұҹиӢҸжү¬е·һжұҹйғҪеӣҪйҷ…еӯҰж Ў2019е№ҙд№қе№ҙзә§еҢ–еӯҰдёҠеҚҠжңҹжңҲиҖғжөӢйӘҢеңЁзәҝзӯ”йўҳ
- 2018еұҠд№қе№ҙзә§12жңҲжңҲиҖғеҢ–еӯҰиҖғйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲж№–еҢ—зңҒеӯқж„ҹеёӮеӯқеҚ—еҢәиӮ–жёҜеҲқзә§дёӯеӯҰгҖҒжҜӣйҷҲдёӯеӯҰзӯүдёғж ЎиҒ”иҖғпјү
- зҰҸе»ә2019е№ҙд№қе№ҙзә§дёҠеӯҰжңҹеҢ–еӯҰжңҲиҖғжөӢйӘҢиҜ•еҚ·е®Ңж•ҙзүҲ
- 2018еұҠд№қе№ҙзә§12жңҲдҪңдёҡжЈҖжҹҘеҢ–еӯҰиҜ•еҚ·пјҲжұҹиӢҸзңҒеҚ—иҸҒй«ҳзә§дёӯеӯҰе®һйӘҢеӯҰж Ўпјү