2018еұұдёңй«ҳдәҢдёҠеӯҰжңҹйІҒ科зүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰдёҺз”ҹжҙ»еҜҶеҲҮзӣёе…іпјҢдёӢеҲ—дёҺзӣҗзұ»ж°ҙи§Јж— е…ізҡ„жҳҜ(гҖҖгҖҖ) AзәҜзўұеҺ»жІ№жұЎВ В В В В В В В В В B.йЈҹйҶӢйҷӨж°ҙеһўВ В В В В C.жҳҺзҹҫеҮҖеҢ–ж°ҙВ В В В В В В В В В D.NH4ClйҷӨй“Ғй”Ҳ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺе®һйӘҢзҺ°иұЎзҡ„жҸҸиҝ°пјҢдёҚжӯЈзЎ®зҡ„жҳҜгҖҖ(гҖҖгҖҖ) A.жҠҠй“ңзүҮе’Ңй“ҒзүҮзҙ§йқ еңЁдёҖиө·жөёе…ҘзЁҖзЎ«й…ёдёӯпјҢй“ңзүҮиЎЁйқўеҮәзҺ°ж°”жіЎ B.з”Ёй“ңжқҝдҪңз”өжһҒз”өи§ЈзЎ«й…ёй“ңжә¶ж¶ІпјҢйҳҙжһҒй“ңжқҝиҙЁйҮҸеўһеҠ C.жҠҠй“ңзүҮжҸ’е…Ҙдёүж°ҜеҢ–й“Ғжә¶ж¶ІдёӯпјҢеңЁй“ңзүҮиЎЁйқўеҮәзҺ°дёҖеұӮй“Ғ D.жҠҠй”ҢзІ’ж”ҫе…Ҙзӣӣжңүзӣҗй…ёзҡ„иҜ•з®ЎдёӯпјҢеҠ е…ҘеҮ ж»ҙж°ҜеҢ–й“ңжә¶ж¶ІпјҢж°”жіЎж”ҫеҮәйҖҹзҺҮеҠ еҝ«
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
В е°ҶдёӢеҲ—зү©иҙЁжә¶дәҺж°ҙпјҢиғҪеӨҹдҝғиҝӣж°ҙзҡ„з”өзҰ»зҡ„жҳҜ(гҖҖгҖҖ) в‘ NaHSO4гҖҖ в‘ЎNa2SO3гҖҖ в‘ўCH3COOHВ В в‘ЈCH3COONaгҖҖ в‘ӨNaHCO3гҖҖ в‘ҘNaClOгҖҖВ в‘ҰNH4HCO3 A.в‘Ўв‘Јв‘Өв‘ҘВ В В В В В В В В В В В В В В В В B.в‘Јв‘Өв‘Ҙв‘Ұ C.в‘ в‘Ўв‘ўВ В В В В В В В В В В В В В В В В В В D.в‘Ўв‘Јв‘Өв‘Ҙв‘Ұ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—жңүе…ійҮ‘еұһи…җиҡҖзҡ„иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) в‘ йҮ‘еұһзҡ„и…җиҡҖе…ЁйғЁжҳҜж°§еҢ–иҝҳеҺҹеҸҚеә”гҖҖ в‘ЎйҮ‘еұһзҡ„и…җиҡҖеҸҜеҲҶдёәеҢ–еӯҰи…җиҡҖе’Ңз”өеҢ–еӯҰи…җиҡҖпјҢеҸӘжңүз”өеҢ–еӯҰи…җиҡҖжүҚжҳҜж°§еҢ–иҝҳеҺҹеҸҚеә”гҖҖ в‘ўеӣ дёәдәҢж°§еҢ–зўіжҷ®йҒҚеӯҳеңЁпјҢжүҖд»Ҙй’ўй“Ғзҡ„з”өеҢ–еӯҰи…җиҡҖд»Ҙжһҗж°ўи…җиҡҖдёәдё»гҖҖ в‘Јж— и®әжҳҜжһҗж°ўи…җиҡҖиҝҳжҳҜеҗёж°§и…җиҡҖпјҢжҖ»жҳҜйҮ‘еұһиў«ж°§еҢ– AпјҺв‘ в‘ўВ В В В В В В В В В В В В В В В В В В В В В BпјҺв‘Ўв‘ўВ В В CпјҺв‘ в‘ЈВ В В В В В В В В В В В В В В В В В В В В В DпјҺв‘ в‘ўв‘Ј
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
е®Өжё©дёӢпјҢжңүдёӨз§Қжә¶ж¶Іпјҡв‘ 0.01 molВ·LпјҚ1 NH3В·H2Oжә¶ж¶ІгҖҒв‘Ў0.01 molВ·LпјҚ1 NH4Clжә¶ж¶ІпјҢдёӢеҲ—ж“ҚдҪңеҸҜд»ҘдҪҝдёӨз§Қжә¶ж¶Ідёӯc(NH A.еҠ е…Ҙе°‘йҮҸH2OВ В В В В В В В В В В В В В B.еҠ е…Ҙе°‘йҮҸNaOHеӣәдҪ“ C.йҖҡе…Ҙе°‘йҮҸHClж°”дҪ“В В В В В В В В В D.еҚҮй«ҳжё©еәҰ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
еҰӮеӣҫжҳҜZnе’ҢCuеҪўжҲҗзҡ„еҺҹз”өжұ пјҢеҲҷдёӢеҲ—з»“и®әдёӯжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) в‘ й“ңдёәйҳіжһҒпјҢй”ҢдёәйҳҙжһҒпјӣ в‘Ўй“ңжһҒдёҠжңүж°”жіЎпјӣ в‘ўSO в‘ЈиӢҘжңү0.5 molз”өеӯҗжөҒз»ҸеҜјзәҝпјҢеҲҷеҸҜдә§з”ҹ0.25 molж°”дҪ“пјӣ в‘Өз”өеӯҗзҡ„жөҒеҗ‘жҳҜй“ңеҲ°й”Ңпјӣ в‘ҘжӯЈжһҒеҸҚеә”ејҸпјҡCuпјӢ2eпјҚ===Cu2пјӢгҖӮ AпјҺв‘ в‘Ўв‘ўВ В В В В В В В В В В В В В В BпјҺв‘Ўв‘Ј CпјҺв‘Јв‘Өв‘ҘВ В В В В В В В В В В В В В В DпјҺв‘ўв‘Јв‘Ө
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
В йҶӢй…ёжә¶ж¶ІдёӯеӯҳеңЁз”өзҰ»е№іиЎЎCH3COOH A.йҶӢй…ёжә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰзҡ„е…ізі»ж»Ўи¶іпјҡc(HпјӢ)пјқc(OHпјҚ)пјӢc(CH3COOпјҚ) B.0.10 molВ·LпјҚ1зҡ„CH3COOHжә¶ж¶ІеҠ ж°ҙзЁҖйҮҠпјҢжә¶ж¶Ідёӯc(OHпјҚ)еҮҸе°Ҹ C.CH3COOHжә¶ж¶ІдёӯеҠ е°‘йҮҸзҡ„CH3COONaеӣәдҪ“пјҢе№іиЎЎйҖҶеҗ‘移еҠЁ D.еёёжё©дёӢпјҢpHпјқ2зҡ„йҶӢй…ёжә¶ж¶ІдёҺpHпјқ12зҡ„NaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲеҗҺпјҢжә¶ж¶Ізҡ„pH<7
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰз”ЁиҜӯжҳҜеӯҰд№ еҢ–еӯҰзҡ„йҮҚиҰҒе·Ҙе…·пјҢдёӢеҲ—з”ЁжқҘиЎЁзӨәзү©иҙЁеҸҳеҢ–зҡ„еҢ–еӯҰз”ЁиҜӯдёӯпјҢжӯЈзЎ®жҳҜпјҲВ В пјү AпјҺз”өи§ЈйҘұе’ҢйЈҹзӣҗж°ҙж—¶пјҢйҳіжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёәпјҡ2Cl - пјҚ2e -=Cl2 вҶ‘ BпјҺж°ўж°§зҮғж–ҷз”өжұ зҡ„иҙҹжһҒеҸҚеә”ејҸпјҡO2 + 2H2O + 4e- = 4OH - CпјҺзІ—й“ңзІҫзӮјж—¶пјҢдёҺз”өжәҗжӯЈжһҒзӣёиҝһзҡ„жҳҜзәҜй“ңпјҢз”өжһҒеҸҚеә”ејҸдёәпјҡCuпјҚ2e- = Cu2+ DпјҺй’ўй“ҒеҸ‘з”ҹз”өеҢ–еӯҰи…җиҡҖзҡ„жӯЈжһҒеҸҚеә”ејҸпјҡFeпјҚ2e - = Fe2+
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁз”ұж°ҙз”өзҰ»дә§з”ҹзҡ„HпјӢжө“еәҰдёә1Г—10пјҚ13molВ·LпјҚ1зҡ„жә¶ж¶ІдёӯпјҢдёҖе®ҡиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜпјҲВ В В пјү A . В KпјӢгҖҒClпјҚгҖҒNO3пјҚгҖҒS2пјҚВ В В В В B .В KпјӢгҖҒFe2пјӢгҖҒIпјҚгҖҒSO42пјҚВ C.В NaпјӢгҖҒClпјҚгҖҒNO3пјҚгҖҒSO42пјҚ D В NaпјӢгҖҒCa2пјӢгҖҒClпјҚгҖҒHCO3пјҚ
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ёжғ°жҖ§з”өжһҒе®һзҺ°з”өи§ЈпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺз”өи§ЈзЁҖзЎ«й…ёжә¶ж¶ІпјҢе®һиҙЁдёҠжҳҜз”өи§Јж°ҙпјҢж•…жә¶ж¶ІpHдёҚеҸҳ BпјҺз”өи§ЈзЁҖж°ўж°§еҢ–й’ жә¶ж¶ІпјҢиҰҒж¶ҲиҖ—OHпјҚпјҢж•…жә¶ж¶ІpHеҮҸе°Ҹ C. з”өи§ЈзЎ«й…ёй’ жә¶ж¶ІпјҢеңЁйҳҙжһҒдёҠе’ҢйҳіжһҒдёҠжһҗеҮәдә§зү©зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә1вҲ¶2 DпјҺз”өи§Јж°ҜеҢ–й“ңжә¶ж¶ІпјҢеңЁйҳҙжһҒдёҠе’ҢйҳіжһҒдёҠжһҗеҮәдә§зү©зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә1вҲ¶1
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘHAзҡ„й…ёжҖ§жҜ”HBејұпјҢеңЁзү©иҙЁзҡ„йҮҸжө“еәҰеқҮдёә0.1 molВ·LпјҚ1зҡ„NaAе’ҢNaBж··еҗҲжә¶ж¶ІдёӯпјҢдёӢеҲ—жҺ’В В еәҸжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A. c(OHпјҚ)пјһc(HA)пјһc(HB)пјһc(HпјӢ) B. c(OHпјҚ)пјһc(AпјҚ)пјһc(BпјҚ)пјһc(HпјӢ) C. c(OHпјҚ)пјһc(BпјҚ)пјһc(AпјҚ)пјһc(HпјӢ) D. c(OHпјҚ)пјһc(HB)пјһc(HA)пјһc(HпјӢ)
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
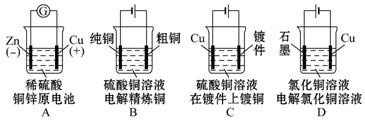
дёӢеҲ—еӣҫзӨәдёӯе…ідәҺй“ңз”өжһҒзҡ„иҝһжҺҘй”ҷиҜҜзҡ„жҳҜгҖҖ(гҖҖгҖҖ)
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зӣёеҗҢзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„й“өзӣҗдёӯпјҢc(NH4+)жңҖеӨ§зҡ„жҳҜ A.NH4HCO3В В В В В B.NH4HSO4В В В В C.NH4NO3В В В В В В D.CH3COONH4
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ | ||
|
В еҰӮеҸіеӣҫжүҖзӨәзҡ„дёӨдёӘе®һйӘҢиЈ…зҪ®дёӯпјҢжә¶ж¶Ізҡ„дҪ“з§ҜеқҮдёә200mLпјҢејҖе§Ӣж—¶з”өи§ЈиҙЁжә¶ж¶Ізҡ„жө“еәҰеқҮдёә0.1molВ·L-1пјҢе·ҘдҪңдёҖж®өж—¶й—ҙеҗҺпјҢжөӢеҫ—еҜјзәҝдёӯеқҮйҖҡиҝҮ0.02molз”өеӯҗпјҢиӢҘдёҚиҖғиҷ‘зӣҗзҡ„ж°ҙи§Је’Ңжә¶ж¶ІдҪ“з§ҜеҸҳеҢ–пјҢдёӢеҲ—еҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜпјҲ пјү AпјҺдә§з”ҹж°”дҪ“зҡ„дҪ“з§Ҝпјҡв‘ пјһв‘Ў BпјҺз”өжһҒдёҠжһҗеҮәзү©иҙЁзҡ„иҙЁйҮҸпјҡв‘ пјһв‘Ў CпјҺжә¶ж¶Ізҡ„pHеҸҳеҢ–пјҡв‘ еўһеӨ§пјҢв‘ЎеҮҸе°Ҹ DпјҺз”өжһҒеҸҚеә”ејҸв‘ дёӯйҳіжһҒпјҡ4OH--4e-= 2H2O+O2вҶ‘В В в‘ЎдёӯиҙҹжһҒпјҡ 2HпјӢпјӢ2eпјҚ=H2вҶ‘
|
|||
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
В еҜ№дәҺ0.1 molВ·LпјҚ1Na2SO3жә¶ж¶ІпјҢжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A. еҚҮй«ҳжё©еәҰпјҢжә¶ж¶ІpHйҷҚдҪҺ B. c(NaпјӢ)пјқ2c(SO C. c(NaпјӢ)пјӢc(HпјӢ)пјқ2c(SO D. еҠ е…Ҙе°‘йҮҸNaOHеӣәдҪ“пјҢc(SO
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
й•Қй•үпјҲNi-CdпјүеҸҜе……з”өз”өжұ еңЁзҺ°д»Јз”ҹжҙ»дёӯжңүе№ҝжіӣеә”з”ЁгҖӮе·ІзҹҘжҹҗй•Қй•үз”өжұ зҡ„з”өи§ЈиҙЁжә¶ж¶ІдёәKOHжә¶ж¶ІпјҢе…¶е……гҖҒж”ҫз”өжҢүдёӢејҸиҝӣиЎҢпјҡCd + 2NiOOH + 2H2O AпјҺе……з”өж—¶йҳіжһҒеҸҚеә”пјҡNi(OH)2пјҚe- + OH- == NiOOH + H2O BпјҺ CпјҺж”ҫз”өж—¶иҙҹжһҒйҷ„иҝ‘жә¶ж¶Ізҡ„зўұжҖ§дёҚеҸҳВ DпјҺж”ҫз”өж—¶з”өи§ЈиҙЁжә¶ж¶Ідёӯзҡ„OH-еҗ‘жӯЈжһҒ移еҠЁ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
В Na2Sжә¶ж¶ІдёӯеӯҳеңЁеӨҡз§Қеҫ®зІ’пјҢдёӢеҲ—еҗ„еҫ®зІ’й—ҙзҡ„е…ізі»жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺc(NaпјӢ)пјһc(S2пјҚ)пјһc(HпјӢ)пјһc(OHпјҚ)пјһc(HSпјҚ) BпјҺc(NaпјӢ)пјӢc(HпјӢ)пјқc(S2пјҚ)пјӢc(HSпјҚ)пјӢc(OHпјҚ) CпјҺc(NaпјӢ)пјқc(HSпјҚ)пјӢ2c(H2S)пјӢ2c(S2пјҚ)В В В В В В DпјҺc(OHпјҚ)пјқc(HпјӢ)пјӢc(HSпјҚ)пјӢ2c(H2S)
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
дёӢеҲ—е®һйӘҢиғҪиҫҫеҲ°йў„жңҹзӣ®зҡ„зҡ„жҳҜ
|
||||||||||||||||
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
е®Өжё©ж—¶пјҢеҗ‘20mL0.1molВ·L-1В йҶӢй…ёжә¶ж¶ІдёӯдёҚж–ӯж»ҙе…Ҙ0.1molВ·L-1В зҡ„NaOHжә¶ж¶ІпјҢжә¶ж¶ІpHВ еҸҳеҢ–еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜ
A. aзӮ№ж—¶пјҡcпјҲCH3COO-пјүпјһcпјҲCH3COOHпјүпјһcпјҲH+пјүпјһcпјҲOH-пјү В BпјҺbзӮ№ж—¶пјҡcпјҲNa+пјү= cпјҲCH3COO-пјүпјһ cпјҲH+пјү= cпјҲOH-пјү В CпјҺcзӮ№ж—¶пјҡcпјҲH+пјү= cпјҲCH3COOHпјү+ cпјҲOH-пјү В DпјҺdзӮ№ж—¶пјҡcпјҲNa+пјүпјһcпјҲCH3COO-пјүпјһcпјҲOH-пјүпјһcпјҲH+пјү
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
з”өи§Јжі•еӨ„зҗҶй…ёжҖ§еҗ«й“¬еәҹж°ҙпјҲдё»иҰҒеҗ«жңүCr2O72-пјүж—¶пјҢд»Ҙй“ҒжқҝдҪңйҳіжһҒпјҢеӨ„зҗҶиҝҮзЁӢдёӯеӯҳеңЁеҸҚеә”Cr2O72-+6Fe2++14H+в•җ2Cr3++6Fe3++7H2OпјҢжңҖеҗҺCr3+д»ҘCrпјҲOHпјү3еҪўејҸйҷӨеҺ»пјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
жә¶ж¶Ідёӯзҡ„еҢ–еӯҰеҸҚеә”еӨ§еӨҡжҳҜзҰ»еӯҗеҸҚеә”гҖӮж №жҚ®иҰҒжұӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)зӣҗзўұең°(еҗ«иҫғеӨҡNa2CO3гҖҒNaCl)дёҚеҲ©дәҺжӨҚзү©з”ҹй•ҝпјҢиҜ•з”ЁзҰ»еӯҗж–№зЁӢејҸиЎЁзӨәпјҡ зӣҗзўұең°дә§з”ҹзўұжҖ§зҡ„еҺҹеӣ пјҡ__________________________________________________гҖӮ (2)е·ІзҹҘж°ҙеӯҳеңЁеҰӮдёӢе№іиЎЎпјҡH2OпјӢH2O (3)еёёжё©дёӢпјҢеңЁpHпјқ6зҡ„CH3COOHдёҺCH3COONaзҡ„ж··еҗҲжә¶ж¶Ідёӯж°ҙз”өзҰ»еҮәжқҘзҡ„c(OHпјҚ)пјқ________________гҖӮжӯӨжә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ (4)ж°Ёж°”зҡ„ж°ҙжә¶ж¶Із§°дёәж°Ёж°ҙпјҢе…¶дёӯеӯҳеңЁзҡ„дё»иҰҒжә¶иҙЁеҫ®зІ’жҳҜNH3В·H2OгҖӮ е·ІзҹҘпјҡa.еёёжё©дёӢпјҢйҶӢй…ёе’ҢNH3В·H2Oзҡ„з”өзҰ»е№іиЎЎеёёж•°еқҮдёә1.74Г—10пјҚ5пјӣ b.CH3COOHпјӢNaHCO3===CH3COONaпјӢCO2вҶ‘пјӢH2OгҖӮ еҲҷCH3COONH4жә¶ж¶Іе‘Ҳ________жҖ§(еЎ«вҖңй…ёвҖқгҖҒвҖңзўұвҖқжҲ–вҖңдёӯвҖқ)пјҢNH4HCO3жә¶ж¶Ідёӯзү©иҙЁзҡ„йҮҸжө“еәҰжңҖеӨ§зҡ„зҰ»еӯҗжҳҜ________(еЎ«зҰ»еӯҗз¬ҰеҸ·)гҖӮ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
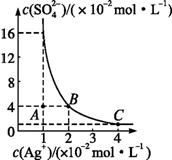
жҹҗжё©еәҰж—¶пјҢAg2SO4еңЁж°ҙжә¶ж¶Ідёӯзҡ„жІүж·Җжә¶и§Је№іиЎЎжӣІзәҝеҰӮеӣҫжүҖзӨәгҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳ:
пјҲ1пјүAзӮ№иЎЁзӨәAg2SO4жҳҜгҖҖгҖҖгҖҖгҖҖ(еЎ«вҖңйҘұе’ҢвҖқжҲ–вҖңдёҚйҘұе’ҢвҖқ)жә¶ж¶ІгҖӮВ BзӮ№еҜ№еә”зҡ„KspгҖҖгҖҖгҖҖгҖҖ(еЎ«вҖң>вҖқвҖң<вҖқжҲ–вҖңпјқвҖқ)CзӮ№еҜ№еә”зҡ„KspгҖӮВ пјҲ2пјүзҺ°е°Ҷи¶ійҮҸзҡ„Ag2SO4еҲҶеҲ«ж”ҫе…Ҙ AпјҺ40 mL 0.01 molВ·LпјҚ1 K2SO4жә¶ж¶І BпјҺ10 mLи’ёйҰҸж°ҙ CпјҺ10 mL 0.02 molВ·LпјҚ1 H2SO4жә¶ж¶І еҲҷAg2SO4зҡ„жә¶и§ЈзЁӢеәҰз”ұеӨ§еҲ°е°Ҹзҡ„жҺ’еҲ—йЎәеәҸдёәгҖҖгҖҖгҖҖВ В В В В В В В гҖҖ(еЎ«еӯ—жҜҚ)гҖӮ пјҲ3пјүеңЁ25в„ғдёӢпјҢеҗ‘жө“еәҰеқҮдёә0.1 mol/Lзҡ„MgCl2е’ҢCuCl2ж··еҗҲжә¶ж¶ІдёӯйҖҗж»ҙеҠ е…Ҙж°Ёж°ҙпјҢе…Ҳз”ҹжҲҗ гҖҖВ В В В жІүж·Җ(еЎ«еҢ–еӯҰејҸ)пјҢз”ҹжҲҗиҜҘжІүж·Җзҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖӮ е·ІзҹҘ25 в„ғж—¶Ksp[Mg(OH)2]пјқ1.8Г—10пјҚ11пјҢKsp[Cu(OH)2]пјқ2.2Г—10пјҚ20гҖӮ пјҲ4пјүеҗ‘BaCl2жә¶ж¶ІдёӯеҠ е…ҘAgNO3е’ҢKBrпјҢеҪ“дёӨз§ҚжІүж·Җе…ұеӯҳж—¶пјҢ [Ksp(AgBr)пјқ5.4Г—10пјҚ13пјҢKsp(AgCl)пјқ2.0Г—10пјҚ10]
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
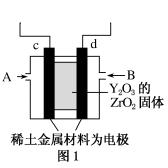
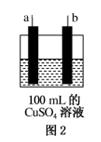
科еӯҰ家еҲ¶йҖ еҮәдёҖз§ҚдҪҝз”ЁеӣәдҪ“з”өи§ЈиҙЁзҡ„зҮғж–ҷз”өжұ пјҢе…¶ж•ҲзҺҮжӣҙй«ҳпјҢеҸҜз”ЁдәҺиҲӘеӨ©иҲӘз©әгҖӮеҰӮеӣҫ1жүҖзӨәиЈ…зҪ®дёӯпјҢд»ҘзЁҖеңҹйҮ‘еұһжқҗж–ҷдҪңжғ°жҖ§з”өжһҒпјҢеңЁA гҖҒBдёӨжһҒдёҠеҲҶеҲ«йҖҡе…Ҙз©әж°”е’ҢCH4пјҢе…¶дёӯеӣәдҪ“з”өи§ЈиҙЁжҳҜжҺәжқӮдәҶY2O3зҡ„ZrO2еӣәдҪ“пјҢе®ғеңЁй«ҳжё©дёӢиғҪдј еҜјйҳіжһҒз”ҹжҲҗзҡ„O2пјҚ(O2пјӢ4eпјҚ===2O2пјҚ)гҖӮ
(1)cз”өжһҒзҡ„еҗҚз§°дёә________пјҢdз”өжһҒдёҠзҡ„з”өжһҒеҸҚеә”ејҸдёә__________________ (2)з”ЁжӯӨз”өжұ з”өи§ЈеҰӮеӣҫ2жүҖзӨәзҡ„100 mL 0.5 molВ·LпјҚ1 CuSO4жә¶ж¶ІпјҢbз”өжһҒдёҠиҙЁйҮҸеўһеҠ пјҢеҲҷbз”өжһҒеә”дёҺеӣҫ1зҡ„В В В В В В пјҲеЎ«cжҲ–dпјүзӣёиҝһпјҢaз”өжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В (3)иӢҘaз”өжһҒдә§з”ҹ56 mL(ж ҮеҮҶзҠ¶еҶө)ж°”дҪ“пјҢеҲҷжүҖеҫ—жә¶ж¶Ізҡ„pHпјқ________(дёҚиҖғиҷ‘жә¶ж¶ІдҪ“з§ҜеҸҳеҢ–)пјҢиӢҘиҰҒдҪҝз”өи§ЈиҙЁжә¶ж¶ІжҒўеӨҚеҲ°з”өи§ЈеүҚзҡ„зҠ¶жҖҒпјҢеҸҜеҠ е…Ҙ________пјҢе…¶иҙЁйҮҸжҳҜВ В В В В В gгҖӮ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗе®һйӘҢе°Ҹз»„еҗҢеӯҰеҜ№з”өеҢ–еӯҰеҺҹзҗҶиҝӣиЎҢдәҶдёҖзі»еҲ—жҺўз©¶жҙ»еҠЁгҖӮ
(2)е…¶д»–жқЎд»¶дёҚеҸҳпјҢиӢҘе°ҶзӣҗжЎҘжҚўжҲҗејҜй“ңеҜјзәҝдёҺзҹіеўЁзӣёиҝһжҲҗnеһӢпјҢеҰӮеӣҫжүҖзӨәгҖӮдёҖж®өж—¶й—ҙеҗҺпјҢеңЁз”ІиЈ…зҪ®дёӯж»ҙеҠ й…ҡй…һиҜ•ж¶ІпјҢе…ҲеҸҳзәўзҡ„жҳҜ______йҷ„иҝ‘зҡ„жә¶ж¶ІпјҲеЎ«вҖңй“ҒвҖқжҲ–вҖңй“ңдёқвҖқпјүпјҢз”өжһҒеҸҚеә”дёә _________________________гҖӮ д№ҷиЈ…зҪ®дёӯзҹіеўЁ(1)дёә________жһҒ(еЎ«вҖңжӯЈвҖқвҖңиҙҹвҖқвҖңйҳҙвҖқжҲ–вҖңйҳівҖқ)пјҢд№ҷиЈ…зҪ®дёӯдёҺй“ңдёқзӣёиҝһзҹіеўЁз”өжһҒдёҠеҸ‘з”ҹзҡ„еҸҚеә”ејҸдёә_________________________пјҢдә§зү©еёёз”Ё__________________________жЈҖйӘҢгҖӮ
|
|
- й«ҳдёүеҢ–еӯҰдёҠеҶҢдё“йўҳз»ғд№ иҜ•еҚ·е®Ңж•ҙзүҲ
- зҷҫиүІеёӮ2019е№ҙй«ҳдёҖеҢ–еӯҰдёҠеҚҠе№ҙжңҲиҖғжөӢйӘҢзҪ‘з»ңиҖғиҜ•иҜ•еҚ·
- 2018е№ҙиҮі2019е№ҙй«ҳдәҢдёҠеҶҢ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰиҜ•еҚ·е®Ңж•ҙзүҲпјҲйқ’жө·зңҒиҘҝе®ҒеёӮ第еӣӣй«ҳзә§дёӯеӯҰпјү
- 2019-2020е№ҙй«ҳдёү10жңҲиҒ”иҖғеҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲжөҷжұҹзңҒдёҪж°ҙеӣӣж Ўпјү
- й«ҳдәҢдёҠжңҹ第дәҢйҳ¶ж®өиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲ2018-2019е№ҙзҰҸе»әзңҒжі°е®Ғ第дёҖдёӯеӯҰпјү
- иҗҘеҸЈеёӮй«ҳдёүеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·йўҳе…Қиҙ№иҜ•еҚ·
- зӣҗжҙҘеҺҝ第дёүдёӯеӯҰй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•ж‘ёеә•иҖғиҜ•йўҳеҗҢжӯҘи®ӯз»ғ
- 2019-2020е№ҙеәҰй«ҳдёҖеҗҺеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲе№ҝдёңзңҒзҸ жө·еёӮзҸ жө·дёҖдёӯ пјү