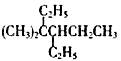2018河北高三上学期人教版高中化学高考模拟
| 1. | 详细信息 |
|
《中国诗词大会》不仅弘扬了中华传统文化,还蕴含着许多化学知识。下列诗句分析正确的是 A.于谦诗句 “粉身碎骨浑不怕,要留清白在人间”,大理石变为石灰的过程涉及到了氧化还原反应 B.刘禹锡诗句“千淘万漉虽辛苦,吹尽狂沙始到金”说明金的化学性质稳定,在自然界中常以单质状态存在 C.赵孟頫诗句“纷纷灿烂如星陨,霍霍喧逐似火攻。”灿烂美丽的烟花是某些金属的焰色反应,属于化学变化 D.龚自珍诗句“落红不是无情物,化作春泥更护花”指凋谢的花可以包裹植物的根,对植物有保护作用
|
|
| 2. | 详细信息 |
|
设NA为阿伏你德罗常数的值,下列说法正确的是 A. 12. 4 g白磷(P4)中所含的P-P键数目为0. 6 NA B.40 g SiC晶体中含有SiC分子的数目为NA个 C. 1 mol淀粉(C6H10O5)水解后产生的葡萄糖分子数目为NA D.标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2NA
|
|
| 3. | 详细信息 | ||||||||||||||||||||
|
下列实验操作,对应的现象和结论均正确的是
|
|||||||||||||||||||||
| 4. | 详细信息 |
|
下列说法正确的是 A.CH3CH=CHCH3分子中的四个碳原子在同一直线上 B.按系统命名法 C.分子式为C4H8ClBr的有机物有11种 D.
|
|
| 5. | 详细信息 |
|
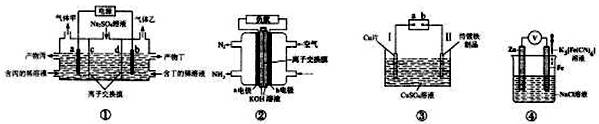
下列几个与电化学相关的装置示意图中,有关叙述正确的是
A.装置①是电解Na2S04溶液联合生产硫酸和烧碱示意图,若气体甲、乙的体积比约为 1∶2,则离子交换膜c、d均为阴离子交换膜,产物丙为硫酸溶液 B.装罝②是NH3燃料电池,a极的电极反应式为:2NH3+60H- -6e-=N2↑+6H2O C.装置③是在待镀铁制品上镀铜的实验装置,电镀过程中电极Ⅱ上Cu2+放电而使溶液中c(Cu2+)逐渐变小 D.装置④是金属牺牲阳极的阴极保护法实验装置,加人K3[Fe(CN)6]溶液后,Fe电极附近会产生特征的蓝色沉淀
|
|
| 6. | 详细信息 |
|
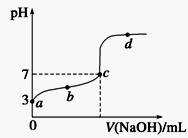
已知,某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL0.1mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法正确的是
A.a点表示溶液中c(CH3COO-)约为10-3 mol/L B.b点表示的溶液中c(CH3COO-) <c(Na+) C.c点表示CH3COOH和NaOH恰好反应完全 D.d点表示的溶液中
|
|
| 7. | 详细信息 |
|
2016年6月8日,国际纯粹与应用化学联合会(IUPAC)公布了新元素的元素符号,113号元素为Nh;ll5号元素为Mc;117号元素为Ts;ll8号元素为Og。关于这四种元素,下列说法正确的是 A. Al的金属性强于Nh B. Mc所在族的某种元素是一种优良的半导体,并在芯片产业中应用广泛 C.气态氢化物的稳定性:HF>HTs D. Og所在族的所有元素都达到了最外层8电子稳定结构
|
|
| 8. | 详细信息 | ||||||||||
|
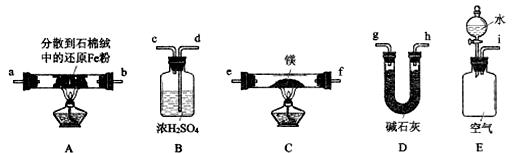
氮化镁(Mg3N2)在工业上应用广泛,通常条件下为黄绿色粉末,极易与水反应,常用作接触媒。 I.氮化镁的制备 下面是甲、乙两位学生提出的制备氮化镁的实验方案示意图(实验前系统内的空气已排除。图中箭头表示气体的流向)。 甲. 乙. (1)Mg3N2的电子式为___________,甲同学的实验方案不能顺利制得氮化镁,原因为________________ (用化学方程式表示)。 (2)乙同学方案中NaOH固体的作用为_____________________________________________。 (3)丙同学利用空气中含有大量N2的事实,用以下装置设计了另外一种制备氮化镁的方案 (夹持装置略去):
① 按气流由左到右的方向,上述装置合理的连接顺序为____________(填接口字母); ② 装置B的作用为___________,装置D的作用为__________________________。 Ⅱ.定性分析产物
Ⅲ.定量测定氮化镁纯度 i.称取4.0 g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL 1.00 mol/L盐酸中,充分反应后,将所得溶液稀释到200.00mL; ii.取20.00 mL稀释后的溶液,用0.2 mol/L NaOH标准溶液滴定过量的盐酸,达到终点时消耗标准溶液25.00 mL。 (6)产物中氮化镁的质量分数为_______________。
|
|||||||||||
| 9. | 详细信息 | |||||||||||||||
|
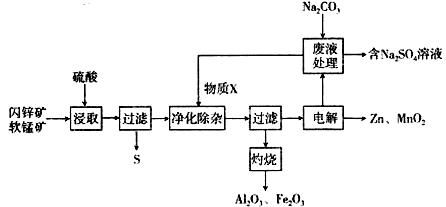
某工厂用软锰矿(主要为MnO2,含杂质Al2O3和闪锌矿(主要为ZnS,含杂质FeS) 共同生产干电池的原料Zn和MnO2,同时获得一些副产品,工艺流程如下:
已知:硫酸浸取液的主要成分为ZnSO4、MnSO4、Fe2(SO4)3、Al2(SO4)3 • (1)“浸取”时发生的反应中,还原产物为_______________ (填化学式)。 (2) ①“净化除杂”时,加入的物质X可能为______________ (填选项字母) A.MnCO3 B. Zn2(OH)2CO3 C.NaOH D. KOH ②相关离子开始沉淀和完全沉淀的pH如下表所示,加入X后,溶液pH应调整到________。
(3)只用一种试剂,即可从 “灼烧”所得的Fe2O3和Al2O3混合物中分离得到Fe2O3。该反应 的离子方程式为____________________________________。 (4)“电解”时,发生反应的化学方程式为____________________________________。 (5)从Na2SO4溶液中得到芒硝晶体(Na2SO4 • 10H2O),需要进行的实验操作有______、_____、过滤、洗涤、干燥等. (6)Zn和MnO2的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为________________________________。 (7)用生产的Zn和MnO2制成干电池,在碱性条件下工作时有MnOOH生成,则该电池正极的电极反应式为________________________________。
|
||||||||||||||||
| 10. | 详细信息 |
|
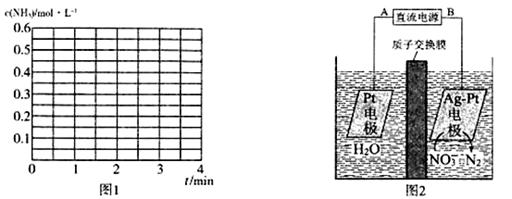
氨气及含氮化合物在化工生产和国防工业中具有广泛应用。请回答: (1)已知:(i)氢气的燃烧热为286.0 kJ• mol-1 (ii)4NH3(g)+3O2(g) ①合成氨反应的热化学方程式为__________________________________。 ②对于反应(ii),正、逆反应活化能的大小关系为:E正_______E逆 (填>、=或<)。 (2)恒温恒容条件下,起始按物质的量之比为1 : 1向密闭容器中充入N2(g)和H2(g),发生合成氨的反应。达平衡后,N2(g)的体积分数为_________;然后只降低温度,N2(g)的体积分数会______(填选项字母)。 A.增大 B.减小 C.不变 D.不能判断 (3)T℃ 时,CO2(g)和 NH3(g)合成尿素的原理为 2NH3(g)+ CO2(g) ① 0-2 min内,用NH3表示的反应速率v(NH3)=___________;反应的平衡常数K=__________。 ②若其他条件不变,2 min时将容器体积迅速压缩到1 L,在3 min时重新达到平衡,请在图1中画出2〜3 min内c(NH3)随时间(t)变化的曲线关系图。
(4)电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图2所示: ① 电源正极为___________(填“A”或“B”),阴极反应式为________________________________。 ②若电解过程中转移了 1 mol e-,则膜两侧电解液的质量变化差值(Δm正-Δm右)为________g。
|
|