2018高三上学期人教版高中化学期中考试
| 1. | 详细信息 |
|
化学在生产和生活中有重要的应用,下列说法不正确的是 A.二氧化氯和三氯化铁都常用于自来水的处理,但二者的作用原理不同 B.14C可用于文物年代的鉴定,14C与12C互为同位素 C.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁 D.新型材料聚酯纤维、光导纤维都属于有机高分子化合物
|
|
| 2. | 详细信息 |
|
将浓盐酸滴入KMnO4溶液,产生黄绿色气体,溶液的紫红色褪去,向反应后的溶液中加入NaBiO3,溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。据此判断下列说法正确的是 A.滴加盐酸时,HCl是还原剂,Cl2是还原产物 B.已知Bi为第ⅤA族元素,上述实验说明Bi具有较强的非金属性 C.若有0.1 mol NaBiO3参加了反应,则整个过程转移电子0.4NA D.此实验条件下,物质的氧化性:KMnO4 > NaBiO3 > Cl2
|
|
| 3. | 详细信息 |
|
NA代表阿伏加德罗常数的数值,下列说法正确的是 A.1mol FeCl3完全水解生成NA个胶体粒子 B.34 g 过氧化氢存在的极性键总数为3 NA C.5.6 g铁和6.4 g铜分别与0.1 mol氯气充分反应,转移的电子数相等 D.标准状况下,2.24 L的CCl4中含有的C—Cl键数为0.4NA
|
|
| 4. | 详细信息 |
|
下列说法正确的是 A.CH3(C2H5)CHCH(CH3)2的系统命名为2—甲基—3—乙基丁烷
C.利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验酒后驾车 D.C5H10的同分异构体中属于烯烃的有6种
|
|
| 5. | 详细信息 |
|
下列反应的离子方程式书写正确的是 A.澄清石灰水与足量小苏打溶液混合:Ca2++OH-+HCO3-==CaCO3↓+H2O B.1mol·L-1 的NaAlO2溶液和2.5mol·L-1的盐酸等体积混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O C.实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O==4Fe3++4OH- D.用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++H2O2==2Mn2++3O2↑+4H2O
|
|
| 6. | 详细信息 | |||||||||||||||
|
下列实验“操作和现象”与“结论”对应关系正确的是
|
||||||||||||||||
| 7. | 详细信息 |
|
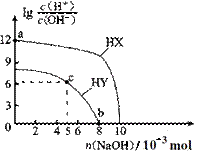
. 常温下,向浓度均为 0.1 mol∙L-1、体积均为 100 mL 的两种一元酸 HX、HY的溶液中,分别加入 NaOH固体,lg[c(H+ )/c(OH- )]随加入 NaOH的物质的量的变化如图所示。下列说法正确的是 A.常温下电离常数:HX < HY B.a 点由水电离出的 c(H+)=10-12 mol∙L-1 C.c 点溶液中:c(Y- )>c(HY ) D.b 点时酸碱恰好完全中和
|
|
| 8. | 详细信息 | |||||||||||
|
绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
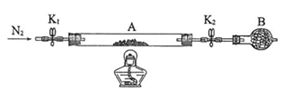
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
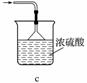
① 仪器B的名称是_____________________。 ② 将下列实验操作步骤正确排序__________(填标号);重复上述操作步骤, a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温 ③根据实验记录,计算绿矾化学式中结晶水数目x=__________(列式表示)。 (3)为进一步探究硫酸亚铁分解的性质及产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
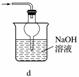
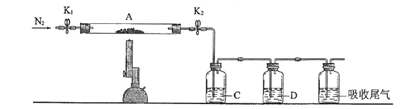 ① C中盛有BaCl2溶液,观察到C中有白色沉淀生成,写出相关反应的离子方程式 。 ② D中所盛的试剂为品红溶液,观察到溶液褪色,写出硫酸亚铁高温分解反应的化学方程式___________________________________________________。 ③ 装置E用于处理尾气,可选用的装置(夹持仪器已略去)为________ (填字母)。
|
||||||||||||
| 9. | 详细信息 |
|
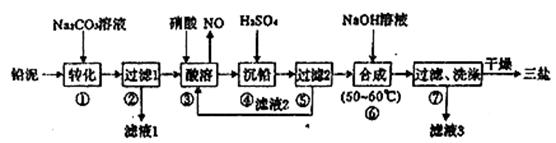
三盐基硫酸铅(3PbO·PbSO4·H2O)简称三盐,白色或微黄色粉末,稍带甜味、有毒。200℃以上开始失去结晶水,不溶于水及有机溶剂。可用作聚氯乙烯的热稳定剂。以铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。
已知:常温下PbSO4的溶解度比PbCO3的溶解度大 请回答下列问题: (1)步骤①转化的目的是____________,滤液1中的溶质为Na2CO3和_________ (填化学式)。 (2)步骤③酸溶时,为提高酸溶速率,可采取的措施是___________(任写一条)。 其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为__________________。 (3)滤液2中可循环利用的溶质为__________(填化学式)。 (4)步骤⑥合成三盐的化学方程式为___________________________________ (5)简述步骤⑦洗涤沉淀的方法________________________________________。
|
|
| 10. | 详细信息 | ||||||||||||
|
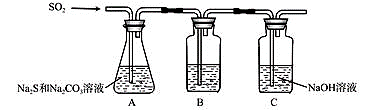
硫化碱法是工业上制备Na2S2O3的方法之一,其反应原理为:2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2(该反应△H>0),某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O的流程如下。
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2 吸收效率低的实验现象是B中溶液 。 ②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 。(答一条) (2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)。
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下: 第一步:准确称取a g KIO3(相对分子质量为214)固体配成溶液; 第二步:加入过量KI固体和H2SO4溶液,滴加指示剂; 第三步: 用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。 则c(Na2S2O3)=_________mol·L-1。 已知:IO3-+5I-+6H+= 3I2+3H2O , 2S2O32-+I2=S4O62-+2I- (4)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能 (填“不受影响”、“偏低”或“偏高”),原因是 。(用离子方程式表示)。
|
|||||||||||||
| 11. | 详细信息 |
|
铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题: (1)铁在元素周期表中的位置 。 (2)配合物Fe(CO)n常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)n晶体属于______(填晶体类型)。Fe(CO)n的中心原子价电子数与配体提供电子数之和为18,则n=______ 。Fe(CO)n在一定条件下发生反应:Fe(CO)n(s) (3)K3[Fe(CN)6]溶液可用于检验 (填离子符号)。CN-中碳原子杂化轨道类型为 ,C、N、O三元素的第一电离能由大到小的顺序为 (用元素符号表示)。
①基态铜原子的核外电子排布式为 。
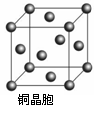
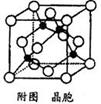
(5)某M原子的外围电子排布式为3s23p5,铜与M形成 化合物的晶胞如附图所示(黑点代表铜原子)。 ①该晶体的化学式为 。 ②已知该晶体的密度为g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 pm(只写计算式)。
|
|
| 12. | 详细信息 |
|
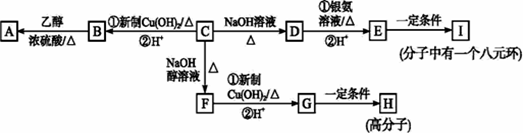
已知有机物C的分子式为C9H9OCl,分子中有一个苯环,苯环上只有一个侧链且不含甲基,一定条件下C能发生银镜反应。C与其他物质之间的转化如图所示(部分无机产物已略去): (1)F中官能团的名称是_____________________;C→F的反应类型是____________。 (2)C的结构简式是______________________,I的结构简式是__________________。 (3)D与银氨溶液反应的化学方程式为_________________________________。 (4)有的同学认为B中可能没有氯原子,理由是_______________________。 (5)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件的W的同分异构体有________种,写出其中核磁共振氢谱有4个峰且能发生银镜反应的结构简式___________________。 ①属于芳香族化合物 ②遇FeCl3溶液不变紫色 ③能与NaOH溶液发生反应
|
|