2018北京高二上学期人教版高中化学期中考试
| 1. | 详细信息 |
|
分类是重要的科学研究方法,下列物质分类不正确的是 A. 电解质:明矾、一水合氨、硫酸钡 B. 酸性氧化物: C. 混合物:铝热剂、矿泉水、水玻璃、漂白粉 D. 同素异形体:
|
|
| 2. | 详细信息 |
|
下列电离方程式中,正确的是 A. B. C. D.
|
|
| 3. | 详细信息 |
|
下列有关“电离平衡”的叙述中正确的是 A. 电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等 B. 电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡 C. 电离平衡是相对的、有条件 D. 电解质达到电离平衡后,各种离子的浓度相等
|
|
| 4. | 详细信息 |
|
当今世界面临日益加剧的能源危机,下列关于能源的描述不正确的是 A. 提高燃料的利 B. 正在探索的新能源有太阳能、氢能、风能、海洋能和生物质能等 C. 新能源的优点是可以再生、没有污染或者很少污染 D. 燃烧热是评价燃料优劣的唯一标准
|
|
| 5. | 详细信息 |
|
已知在 A. B. C. D.
|
|
| 6. | 详细信息 |
|
250℃和 A. 是吸热反应 B. 是放热反应 C. 是熵减少的反应 D. 熵增大效应大
|
|
| 7. | 详细信息 |
|
下列与化学反应能量变化相关的叙述正确的是 A. 生成物能量一定低于反应物总能量 B. 放热反应的反应速率总是大于吸热反应的反应速率 C. 应用盖斯定律,可计算某些难以直接测量的反应焓变 D. 同温同压下,
|
|
| 8. | 详细信息 | ||||||||||||
|
常温下,
A. B. 表中最稳定的共价键是H-F键 C. D.
|
|||||||||||||
| 9. | 详细信息 |
|
下列热化学方程式中, A. B. C. D.
|
|
| 10. | 详细信息 |
|
下列措施能明显增大原反应的化学反应速率的是 A. B. 将稀 C. 在 D. 恒温恒容条件下,在工业合成氨反应中,增加氮气的量
|
|
| 11. | 详细信息 |
|
在已经处于化学平衡状态的体系中,如果下列量发生变 A. 反应混和物的浓度 B. 反应物的转化率 C. 正、逆反应速率 D. 反应混和物的压强
|
|
| 12. | 详细信息 |
|
在一密闭容器中,充入一定量的反应物A,反应 A. 平衡向正反应方向移动了 B. 物质A的转化率降低 C. 物质B的质量增加 D.
|
|
| 13. | 详细信息 |
|
对常温下 A. B. 加入少量 C. 该溶液中由 D. 与等体积
|
|
| 14. | 详细信息 |
|
下列说法中正确的是 A. 水是极弱的电解质,它能微弱电离生成 B. 向水中加入稀氨水,平衡逆向移动, C. D.
|
|
| 15. | 详细信息 |
|
A. ①②④ B. ①④⑥ C. ②③⑥ D. ③⑤⑥
|
|
| 16. | 详细信息 |
|
近年来,我国北京等地出现严重雾霾天气,据研究,雾霾的形成与汽车排放的
|
|
| 17. | 详细信息 |
|
下列事实不能用勒夏特列原理解释的是 A. 实验室常用排饱和食盐水的方法收集氯气 B. 在硫酸亚铁溶液中,加入铁粉以防止氧化 C. 酯在碱性条件下水解的程度较为完全 D. 氨水应密闭保存,放置低温处
|
|
| 18. | 详细信息 |
|
某温度下,体积一定的密闭容器中进行反应: A. 平衡后加入 B. 平衡后升高温度,平衡常数K变大 C. 平衡后再充入 D. 若反应前充入的
|
|
| 19. | 详细信息 |
|
已知 A.
|
|
| 20. | 详细信息 | ||||||||||||||
|
下列实验事实不能用平衡移动原理解释的是 A. B.
C. D.
|
|||||||||||||||
| 21. | 详细信息 |
|
某 A. B. C. D.
|
|
| 22. | 详细信息 |
|
某温度下,在 A. m=2 B. 两次平衡的平衡常数相同 C. X与Y的平衡转化率之比为1:1 D. 第二次平衡时,Z的浓度为
|
|
| 23. | 详细信息 |
|
某温度下反应 A. 反应正好达平衡 B. 反应向逆反应方向进行 C. 反应向某方向进行一段时间后 D. 反应向某方向进行一段时间后
|
|
| 24. | 详细信息 | ||||||||||||||
|
在一定温度下,
下列叙述不正确的是(溶液体积变化忽略不计) A. B. C. 反应到 D. 反应到
|
|||||||||||||||
| 25. | 详细信息 |
|
A. B. 该反应的 C. 平衡常数: D. 在C点时,CO转化率为75%
|
|
| 26. | 详细信息 |
|
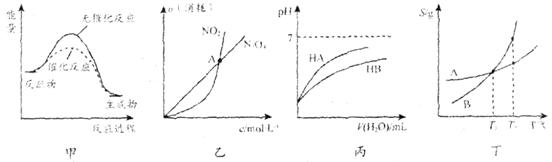
下列关于各图像的解释或结论不正确的是
A. 由甲可知:使用催化剂不影响反应热 B. 由乙可知:对于恒温恒容条件下的反应 C. 由丙可知:同温度、同浓度的HA溶液比HB溶液酸性强 D. 由丁可知:将
|
|
| 27. | 详细信息 |
|
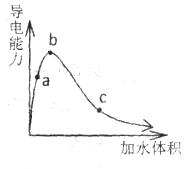
一定温度下,将一定质量的纯醋酸加水稀释,经实验测定溶液的导电能力变化如图所示,下列说法中正确的是
A. a、b、c三点溶液的pH: B. a、b、c三点醋酸的电离程度: C. 若用湿润的pH试纸测量a处的pH,测量结果偏小 D. 物质的量浓度分别为a、b、c三点的溶液各
|
|
| 28. | 详细信息 | |||||||||||||||
|
已知:
A. ①和③ B. ②和④ C. ③和④ D. ①和②
|
||||||||||||||||
| 29. | 详细信息 |
|
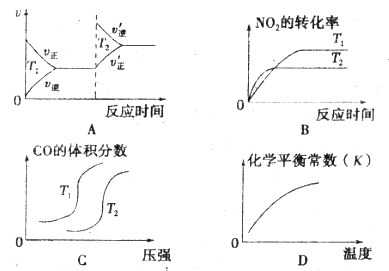
接触法制 (1)恒温恒容条件下,下列能说明此反应已达平衡的是________。 ① ②容器中气体的平均摩尔质量不随时间而变化 ③容器中气体的密度不随时间而变化 ④容器中气体分子总数不随时间而变化 (2)下列有关该反应速率的叙述中,正确的是_________。 a. 升高温度可以增大活化分子百分数,加快反应速率 b. 使用催化剂提高二氧化硫的转化率 c. 使用催化剂可以使反应物分子平均能量升高, d. 缩小容器体积增大压强不能增大活化分子百分数,但可以加快反应速率 (3)下图表示将
(4)一定温度下,在容积不变的密闭容器中充入 a. c. (5)
|
|
| 30. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||||||||
|
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验: 【实验原理】 【实验内容及记录】
请回答: (1)根据上表中的实验数据,可以得到的结论是___________。 (2)利用实验1中数据计算,用
(3)该小组同学根据经验绘制了 该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是____________。 ②请你帮助该小组同学完成实验方案,并填写表中空白。
③若该小组同学提出的假设成立,应观察到的现象是______________。
|
|||||||||||||||||||||||||||||||||||||||||||||||
| 31. | 详细信息 | ||||||||||||||||||||
|
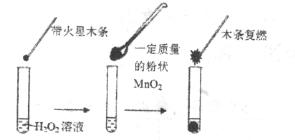
研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
(1)甲同学欲用下图所示实验来证明 (2)为探究
由此得出的结论是______________。 (3)为分析
结论是___________,实验III的目的是___________。 (4)①查阅资料得知:将作为催化剂的 ②在上述实验过程中,分别检测出溶液中有二价锰、二价铁和一价铜,由此得出选择作为
|
|||||||||||||||||||||