2020福建高三上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
对中国古代著作涉及化学的叙述,下列解说错误的是 A.《汉书》中“高奴县有洧水可燃”,这里的“洧水”指的是石油 B.《黄白第十六》中“曾青涂铁,铁赤如铜”,其“曾青”是可溶性铜盐 C.《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”指的是Ca(OH)2 D.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的“碱”是K2CO3
|
|
| 2. | 详细信息 |
|
下列说法中正确的是 A.生石灰可用作食品抗氧化剂 B.焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化 C.分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3 胶体<FeCl3溶液 D.“海水淡化”可以解决“淡水供应危机”,但加入明矾不能使海水淡化
|
|
| 3. | 详细信息 |
|
下列分类依据和结论都正确的是 A. NaF、MgO、CaCl2均由活泼金属和活泼非金属作用形成,都是离子化合物 B. HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 C. Na2O、HCl、BaSO4、浓硝酸都是纯净物 D. HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸
|
|
| 4. | 详细信息 |
|
实验室中不同的试剂有不同的保存方法,下列保存方法错误的是 A.保存硫酸亚铁溶液需加入铁粉和少量硫酸 B.保存浓硝酸需用带橡胶塞的棕色细口瓶 C.溴化银固体保存在棕色玻璃塞广口瓶中 D.金属钠保存在装有煤油的玻璃塞广口瓶中
|
|
| 5. | 详细信息 |
|
一定温度和压强下,30L某种气态纯净物质中含有6.02×1023个分子,这些分子由1.204×1024个原子组成,下列说法错误的是 A.每个该气体分子含有2个原子 B.该温度和压强可能是标准状况 C.标准状况下该纯净物若为气态,其体积约是22.4 L D.若O2在该条件下为气态,则1mol O2在该条件下的体积也为30 L
|
|
| 6. | 详细信息 |
|
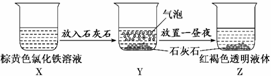
某同学在实验室进行了如图所示的实验,下列说法中错误的是
A.X、Z烧杯中分散质相同 B.Y中反应离子方程式为3CaCO3+2Fe3++3H2O==2Fe(OH)3(胶体)+3CO2↑+3Ca2 C.利用过滤的方法,可将Z中固体与液体分离 D.Z中分散系能产生丁达尔效应
|
|
| 7. | 详细信息 |
|
下列有关实验操作或测量数据的说法正确的是 A.用托盘天平称量食盐的质量为12.35 g B.用碱式滴定管量取高锰酸钾溶液20.00 mL C.用pH试纸测量次氯酸钠溶液的pH为11.5 D.滴定管、容量瓶和分液漏斗在使用前都要先查漏
|
|
| 8. | 详细信息 |
|
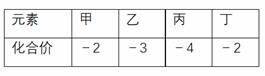
短周期元素甲、乙、丙、丁的原子半径依次增大,其氢化物中甲、乙、丙、丁的化合价如表所示。下列说法正确的是
A. 氢化物的沸点:甲>丁 B.元素非金属性:甲<乙 C.含氧酸的酸性:乙 <丁 D.丙的氧化物为离子化合物
|
|
| 9. | 详细信息 |
|
将SO2分别通入下列各溶液中,下列有关说法正确的是
A.试管a中实验可以证明SO2具有漂白性 B.试管b中溶液褪色,说明SO2具有强氧化性 C.试管c中能产生白色沉淀,说明SO2具有还原性 D.试管d中能产生白色沉淀,加入稀硝酸后沉淀完全溶解
|
|
| 10. | 详细信息 |
|
下列有关硫元素及其化合物的说法或描述正确的是 A.硫黄矿制备硫酸经历两步: B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中 C.闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性 D.在燃煤中加入石灰石可减少SO2排放,发生的反应为
|
|
| 11. | 详细信息 |
|
下列有关物质的性质类比正确的是 A.已知 B.Fe能与CuSO4溶液反应,可知Al与CuSO4溶液也能反应 C.CaSO3与稀盐酸反应生成SO2,可知CaSO3与稀硝酸反应也生成SO2 D.已知H2O2能氧化I-,可知H2O2也能氧化Cl-
|
|
| 12. | 详细信息 |
|
下列有关卤素的说法错误的是 A.新制氯水显浅黄绿色,但放置一段时间之后颜色会褪去 B.HF、HCl、HBr、HI的热稳定性依次减弱,还原性依次增强 C.淀粉碘化钾在空气中变蓝,发生了4I−+O2+2H2O=2I2+4OH− D.由HF、HCl、HBr、HI酸性递增的事实,可推出F、Cl、Br、I的非金属性递增
|
|
| 13. | 详细信息 |
|
NA代表阿伏加德罗常数的值。下列说法正确的是 A.常温常压下,124 g P4中所含P—P键数目为4NA B.标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA C.1mol FeI2与足量氯气反应时转移的电子数为2NA D.13g由
|
|
| 14. | 详细信息 |
|
某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶性杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法正确的是
A.起始滤液的pH=7 B.试剂Ⅰ为Ba(NO3)2溶液 C.步骤②中加入试剂Ⅱ的目的是除去Ba2+ D.图示的步骤中必须经过2次过滤操作
|
|
| 15. | 详细信息 |
|
海水开发利用的部分过程如图所示。下列说法错误的是 A.向苦卤中通入Cl2是为了提取溴 B.工业生产中常选用NaOH作为沉淀剂 C.粗盐可采用除杂和重结晶等过程提纯 D.富集溴一般先用热空气或水蒸气吹出单质溴,再用SO2将其还原吸收
|
|
| 16. | 详细信息 |
|
某同学向一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次): a.KI溶液;b.淀粉溶液;c.NaOH溶液;d.稀硫酸;e.氯水。发现溶液颜色按如下顺序变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色。 下列叙述错误的是 A.加入以上药品的顺序是a→e→b→c→d B.溶液由棕黄色变为蓝色的原因是淀粉溶液遇碘变蓝色 C.③→④反应的化学方程式为I2+2NaOH=NaI+NaIO+H2O D.④→⑤反应的离子方程式为2I-+Cl2=I2+2Cl-
|
|
| 17. | 详细信息 |
|
在新制饱和氯水中,若只改变某一条件,下列叙述正确的是 A.再通入少量氯气, B.通入少量SO2,溶液漂白性增强 C.加入少量的NaHCO3粉末,pH增大,溶液漂白性增强 D.光照过程中,有气泡冒出,溶液的导电性减弱
|
|
| 18. | 详细信息 |
|
溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和某些非金属单质反应生成相应的卤化物,跟水反应的化学方程式为IBr+H2O=HBr+HIO。下列说法错误的是 A.IBr是双原子分子 B.在很多反应中,IBr是强氧化剂 C.和水反应时,IBr既是氧化剂又是还原剂 D.IBr和NaOH溶液反应,生成NaBr和NaIO
|
|
| 19. | 详细信息 | |||||||||||||||
|
为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂。
对实验现象的“解释或结论”错误的是
|
||||||||||||||||
| 20. | 详细信息 |
|
短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示。下列说法一定正确的是 A.最高正化合价:Z>X B.X、Y、Z的单质中,Z的熔点最高 C.若X为非金属元素,则离子半径:Xn->Ym->Zm- D.若X为金属元素,则X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强
|
|
| 21. | 详细信息 |
|
本题为选修《有机化学基础》 A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):
已知: 回答下列问题: (1)B的结构简式为____________,C中含有的官能团名称是______________。 (2)若D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子,D中氧元素的质量分数约为13.1%,则D的结构简式为__________________,⑥的反应类型是________________。 (3)写出苯乙醛与新制的银氨溶液反应的离子方程式:________________________ _________________________________________________________________________。 (4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:________________。 i .含有苯环和 ii.核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1 (5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色的E的所有同分异构体共有(不考虑立体异构)__________种。 (6)参照
|
|
| 22. | 详细信息 |
|
“84消毒液”是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒。某“84消毒液”瓶体部分标签如图1所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
图1 图2 (1)此“84消毒液”的物质的量浓度约为________。(计算结果保留一位小数) (2)某同学量取100mL此“84消毒液”,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)=________mol/L。 (3)该同学参阅读该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为24%的消毒液。 ①如图2所示的仪器中配制溶液需要使用的是______________________(填仪器序号),还缺少的玻璃仪器是__________________________________________。 ②该同学配制此溶液需称取称量NaClO固体的质量为_________________g。 (4)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是____________(填序号)。 A.定容时俯视刻度线[ B.转移前,容量瓶内有蒸馏水 C.未冷至室温就转移定容 D.定容时水多加了,用胶头滴管吸出
|
|
| 23. | 详细信息 | ||||||||||||
|
氯气可用于制取漂白剂和自来水消毒。 (1)将氯气通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物质是________(填化学式)。 (2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为_________________________________________________。 (3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验: 步骤1:将5 mL市售“84”消毒液稀释100倍,测得稀释后溶液的pH=12; 步骤2:将稀释后溶液各20 mL分别加入3个洁净的小烧杯中; 步骤3:用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7 和4。(溶液体积变化忽略不计) 步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
①由实验现象可获得以下结论:溶液的pH在4~10范围内,pH越大,红纸褪色_____________。 ②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是________________________ _______________________________________ ________________________________________。 (4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO 2气体就是一种新型高效含氯消毒剂。 ①一种制备 ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,写出该反应的 离子方程式___________________________________________________________。 ②另一种制备 ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占1/3,每生成0.5 mol ClO2,转移________mol电子。
|
|||||||||||||
| 24. | 详细信息 |
|
氯化亚砜(SOCl2)是一种液态化合物,在农药、制药行业中用途广泛。实验室合成原理为:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:
已知:①SOCl2 沸点为78.8℃,SCl2 的沸点为50℃,且两种液体可互溶。 ②SOCl2 遇水剧烈反应,液面上产生白雾,并带有刺激性气味的有气体产生。 ( 1 )实验室制取SOCl2在三颈烧瓶中进行,整个装置所选仪器的连接顺序是: ⑥→_____________________→①,②←____________________(某些仪器可以多次使用)。 (2)仪器a的名称是________,仪器b的作用是_________________________________。 (3)本实验中制Cl2的离子方程式为_________________________________________,本实验中制SO2的化学方程式为__________________________________________________, SOCl2与水反应的化学方程式为__________________________________________________。 (4)实验结束后,从三颈烧瓶分离出SOCl2的实验操作名称是_________________。若反应中消耗Cl2的体积为896 mL(标准状况,SO2足量),最后得到纯净的SOCl2 7.14 g,则SOCl2的产率为_________________。
|
|
| 25. | 详细信息 | ||||||||||||
|
选考题(15分) I. 本题为选修《物质结构与性质》 O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题: (1)O原子中价电子占据的轨道数目为______________。 (2)第一电离能I1:N__________O(填“>”或“<”),第二电离能I2:O大于N的原因是_____________________________________________________________________________ (3)O3的空间构型为__________________;分子中存在大π键,可用符号Π (4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H—N、____________________、 __________________________(任写两种即可)。 (5)已知:表格中键能和键长数目。
N2和N4都是N元素的单质,其中N4是正四面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是___________________________ ______________________________________________________________________。
|
|||||||||||||