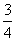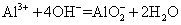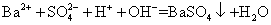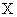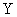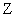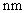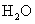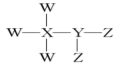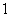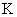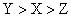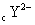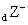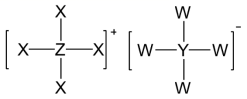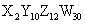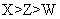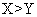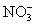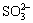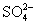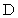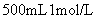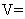高中化学必修一2020-2021学年度——元素周期律综合复习题(二)
| 1. | 详细信息 |
|
2018 年是门捷列夫诞辰 184 周年。下列事实用元素周期律不能解释的是 A . 沸点: H 2 O>H 2 S B . 碱性: KOH>NaOH C . 酸性: HClO 4 >H 2 SO 4 D . 元素的金属性: Mg>Al |
|
| 2. | 详细信息 |
|
下列各组微粒不是按半径逐渐增大的顺序排列的是 A . Na 、 K 、 Rb B . F 、 Cl 、 Br C . Mg 2+ 、 Al 3+ 、 Zn 2+ D . Cl - 、 Br - 、 I - |
|
| 3. | 详细信息 |
|
有 X、Y、Z三种元素,它们的原子序数都小于20,对应离子X + 、 Y 2- 、 Z - 具有相同的电子层结构。有关描述中正确的是 A . 原子序数: Z>X>Y B . 还原性: Z - >Y 2- C . Z元素最高价为+7 D . X与Y可形成X 2 Y 2 化合物 |
|
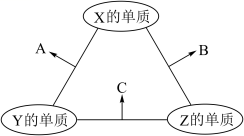
| 4. | 详细信息 |
|
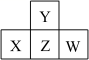
短周期主族元素 X 、 Y 、 Z 、 W 的原子序数依次增大,它们原子的最外层电子数之和为 16 , Y 的单质是空气中含量最多的气体, Z 原子的最外层电子数是其内层电子数的 3 倍, W 是短周期中金属性最强的元素。下列说法正确的是 A . X 最高价氧化物对应的水化物为强酸 B . 原子半径: r (W) > r (X) > r (Y) > r (Z) C . X 、 Y 、 Z 的非金属性依次减弱 D . 由 Z 和 W 组成的化合物只有一种 |
|
| 5. | 详细信息 |
|
如图为元素周期表的一部分, X 、 Y 、 Z 、 W 均为短周期元素,若 Z 原子最外层电子数是次外层电子数的 A . X 、 Y 二种元素都仅能形成一种单质 B . X 与 O 2 反应的产物可作为干燥 NH 3 的干燥剂 C . Z 的氧化物中有一种是形成酸雨的主要物质 D . W 不能形成含氧酸 |
|
| 6. | 详细信息 |
|
下列化学反应的离子方程式正确的是 A . 用小苏打治疗胃酸过多: B . 往碳酸钡中滴加稀盐酸: C . 往氨水中滴加氯化铝: D . 氢氧化钡溶液与稀硫酸反应: |
|
| 7. | 详细信息 |
|
短周期主族元素 X 、 Y 、 Z 、 W 的原子序数依次增大,常温下, X 的氢化物呈液态, Z 与 X 形成的某淡黄色离子化合物 R 可用作漂白剂, W 的最高价氧化物对应的水化物为中强酸。下列说法中错误的是 A . 最简单氢化物的还原性: Y < W B . R 中含非极性共价键 C . Y 的单质在其同族元素单质中沸点最高 D . 简单离子的半径: Y > Z |
|
| 8. | 详细信息 | |||||||||||||||
|
下列有关说法正确的是 A . 元素 B . 元素 C . 元素 D . 四种元素中,元素 |
||||||||||||||||
| 9. | 详细信息 |
|
已知 W 、 X 、 Y 、 Z 为原子序数依次增大的短周期主族元素, W 与 X 、 Y 、 Z 均能形成 10 电子分子,其中 Y 的最简单的氢化物易与其最高价氧化物对应的水化物反应生成化合物甲, W 、 X 、 Y 、 Z 可以形成化合物乙 ( 结构如图 ) ,下列说法正确的是 A . W 不能和 X 、 Y 形成 18 电子的化合物 B . 甲中含有离子键和非极性共价键 C . 原子半径: X>Y>Z>W D . W 与 X 形成的化合物的沸点一定低于 W 与 Z 所形成的化合物 |
|
| 10. | 详细信息 | ||||||||||||||||||||
|
下列选项中,有关实验操作、现象和结论都正确的是
A . A B . B C . C D . D |
|||||||||||||||||||||
| 11. | 详细信息 | ||||||||||
|
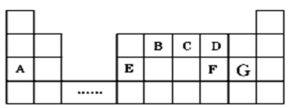
短周期元素 W 、 X 、 Y 和 Z 在元素周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为 21 。下列关系正确的是
A . 非金属性: W > X B . 简单离子的半径: Y < X C . 气态氢化物的热稳定性: W > X D . 最高价氧化物对应水化物的酸性: Y > W |
|||||||||||
| 12. | 详细信息 |
|
四种短周期元素 X 、 Y 、 Z 和 W 在周期表中的位置如图所示。下列说法不正确的是 A . 原子半径 (r) : r(Y)>r(Z)>r(W) B . W 的氧化物的水化物一定是强酸 C . Y 和 W 的最高化合价之和为 8 D . 简单氢化物的热稳定性: X>Z |
|
| 13. | 详细信息 |
|
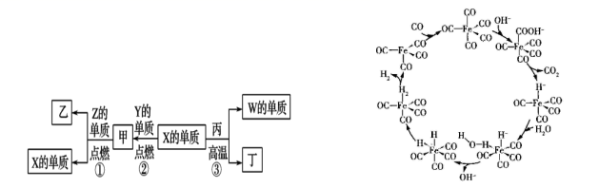
X 、 Y 、 Z 、 W 为原子序数递增的四种短周期元素,其中 Z 为金属元素,其单质与水反应后溶液能使酚酞试液变为浅红色, X 、 W 为同一主族元素, Y 是地壳中含量最高的元素。甲、乙、丙分别为 X 、 Z 、 W 形成的最高价氧化物,丁是如图循环中的一个反应物。下列判断错误的是 A . W 位于元素周期表第三周期 Ⅳ A 族 B . 简单原子半径: r(Z)>r(W)>r(Y)>r(X) C . 丁为 CO ,反应 ③为工业制粗硅的原理 D . 该循环过程实现了一氧化碳与水反应制取氢气 |
|
| 14. | 详细信息 | ||||||||
|
五种短周期元素在元素周期表中的位置如下,已知 Y 原子最外层电子数是其电子层数的 2 倍,下列说法不正确的是
A . 五种元素中原子半径最大的是 X ,离子半径最大的是 Y 单核离子 B . X 与 M 、 X 与 Z 形成的化合物化学键类型相同 C . 工业上 M 单质可以制 X 单质,这个事实可证明非金属性 M > X D . Y 或 Z 的某些化合物都具有漂白性 |
|||||||||
| 15. | 详细信息 |
|
已知 W 、 X 、 Y 、 Z 为短周期元素,原子序数依次增大。 W 、 Z 同主族, X 、 Y 、 Z 同周期,其中只有 X 为金属元素。下列说法一定正确的是 A . 原子半径: X > Y > Z > W B . W 的含氧酸的酸性比 Z 的含氧酸的酸性强 C . W 的气态氢化物的熔沸点低于 Y 的气态氢化物 D . 若 W 与 X 原子序数差为 5 ,则形成化合物的化学式为 X 3 W 2 |
|
| 16. | 详细信息 |
|
下列各组物质的性质比较,不正确的是 A . 酸性: C . 氢化物稳定性: |
|
| 17. | 详细信息 |
|
某溶液中可能含有如下离子: A . 原溶液中一定含有的阳离子是 B . 原溶液中可能含有 C . 原溶液中 D . 原溶液中 |
|
| 18. | 详细信息 |
|
第 75 号元素铼是广泛用于航空发动机涡轮叶片的稀土元素。从信息中不能获取的是( ) A . 质量数 B . 周期表中位置 C . 质子数 D . 核外电子排布 |
|
| 19. | 详细信息 | |||||||||
|
X 、 Y 、 Z 三种元素在周期表中的位置如图。下列说法正确的是
A . 原子半径: Y < X B . 单质氧化性: X > Y C . 离子半径: Y > Z D . X 的简单氢化物比 Y 的简单氢化物稳定 |
||||||||||
| 20. | 详细信息 |
|
下列各组元素中按微粒半径递增顺序排列的是 A . |
|
| 21. | 详细信息 |
|
a 、 b 、 c 、 d 是四种短周期元素。 a 、 b 、 d 同周期, c 、 d 同主族。 a 的原子结构示意图 ( 如下图 ) , b 与 c 形成化合物的电子式为 A . 原子半径: a > c > d > b B . 电负性 a > b > d > c C . 原子序数: d > a > c > b D . 最高价含氧酸的酸性 c > d > a |
|
| 22. | 详细信息 |
|
已知短周期元素的离子, A 2+ , B + , C 3- , D - 都具有相同的电子层结构,则下列叙述正确的是 A . 离子半径 C 3- > D - > B + > A 2+ B . 原子序数 D > C > B > A C . 原子半径 A > B > D > C D . 元素的电负性 A > B > D > C |
|
| 23. | 详细信息 |
|
居室装修用石材的放射性常用 226 Ra 作为标准,居里夫人 (MarieCurie) 因对 Ra 元素的研究两度获得诺贝尔奖。下列叙述中正确的是 A . Ra 位于元素周期表 d 区 B . Ra 元素位于元素周期表中第六周期 Ⅱ A 族 C . 一个 226 Ra 原子中含有 138 个中子 D . Ra(OH) 2 是一种两性氢氧化物 |
|
| 24. | 详细信息 |
|
关于卤素 X( 依次为 F 、 Cl 、 Br 、 I) 的下列叙述正确的是 A . 卤素单质与水反应均可用 X 2 +H 2 O B . HX 都极易溶于水,其水溶液均是强酸 C . 卤素单质的颜色随相对分子质量增大而加深 D . 卤素单质均具有强氧化性,能将 Fe 氧化到 +3 价 |
|
| 25. | 详细信息 |
|
下列有关碱金属的说法正确的是 A . 碱金属单质在空气中燃烧的生成物都是过氧化物 B . 单质的还原性: Li>Na>K>Rb>Cs C . 钾的金属性比钠强,因此钾可以从氯化钠溶液中置换出钠 D . 由 Li 到 Cs ,核电荷数依次增加,电子层数、原子半径依次增大 |
|
| 26. | 详细信息 |
|
2016 年 IUPAC 将第 117 号元素命名为 Ts ,中文名 “石田”,音 tian 。下列说法中,不正确的是 A . Ts 的最外层电子数是 7 B . Ts 的单质在常温下是气体 C . Ts 在同族元素中非金属性最弱 D . Ts 在同族元素中原子半径最大 |
|
| 27. | 详细信息 | ||||||
|
四种短周期元素 X 、 Y 、 Z 和 W 在周期表中的位置如图所示,原子序数之和为 48 ,下列说法不正确的是
A . Z 的最低价单核阴离子的失电子能力比 Y 的强 B . 由于 W 的非金属性比 Z 的强,所以 W 氢化物的沸点比 Z 的高 C . 原子半径 (r) 大小比较: r(X) > r(Y) D . X 和 W 可形成共价化合物 XW 3 |
|||||||
| 28. | 详细信息 |
|
有 A . B . C . D . |
|
| 29. | 详细信息 |
|
短周期主族元素 R 、 X 、 Y 、 Z 的原子序数依次增大, R 元素最高正价和最低负价的代数和为 2 ,在短周期主族元素中 X 原子半径最大, Y 的单质可与某些金属氧化物反应用于焊接钢轨, Z 元素形成的单质可使湿润的有色布条褪色。下列说法错误的是 A . 最高价氧化物对应水化物的碱性: X > Y B . R 元素的氢化物可用作制冷剂 C . Y 在地壳中的含量居第三 D . Z 形成的含氧酸酸性最强 |
|
| 30. | 详细信息 |
|
短周期元素的离子 A . 原子序数: B . 气态氢化物的还原性: H 2 Y > HZ C . 原子半径: D . 碱性: |
|
| 31. | 详细信息 |
|
应用元素周期律判断下列语句,其中正确的组合是 ①碱金属 ( 即 Ⅰ A 族 ) 单质的熔点随原子序数的增大而降低 ②砹 (At) 是第 Ⅶ A 族元素,其氢化物的稳定性大于 HCl ③硒 (Se) 的最高价氧化物对应水化物的酸性比硫酸弱 ④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 ⑤铊 (Tl) 与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 ⑥第三周期金属元素的最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱 A . ①③④ B . ①③⑥ C . ③④⑤ D . ②④⑥ |
|
| 32. | 详细信息 |
|
一种离子化合物 ( 如图所示 ) ,可用作分析试剂、杀虫剂在纺织印染工业中用作树脂整理催化剂,其中 X 、 Y 、 Z 、 W 为短周期元素且原子序数依次增大。 Y 、 Z 可形成新型陶瓷,是一种超硬材料,硬度仅次于金刚石, X 、 W 形成的化合物易溶于水,其水溶液显弱酸性。下列叙述正确的是 A . W 的最高价氧化物的水化物的化学式为: HWO 4 B . 气态氢化合物的稳定性: Z>Y C . 该化合物中存在离子键、共价键、配位键,且 1mol 该化合物中有 1mol 配位键 D . Y 的最高价氧化合物的水化物是二元弱酸 |
|
| 33. | 详细信息 |
|
某种宝玉石主要成分的化学式为 A . 原子半径: B . X 、 Z 、 W 组成的化合物的水溶液显中性 C . 最高价氧化物对应水化物的碱性: D . 工业上常用电解熔融 X 的氯化物制备 X 的单质 |
|
| 34. | 详细信息 |
|
类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论不正确的是 A . 根据钠有强还原性,推测 K 也有强还原性 B . 相同温度下, CaCO 3 的溶解度比 Ca(HCO 3 ) 2 的溶解度小,则 Na 2 CO 3 的溶解度也小于 NaHCO 3 的溶解度 C . 由氢化物的稳定性: H 2 O > NH 3 ,推测氢化物的稳定性也是: H 2 S > PH 3 D . 由 Ca(ClO) 2 +CO 2 +H 2 O=CaCO 3 ↓ +2HClO 推测 Ca(ClO) 2 +SO 2 +H 2 O=CaSO 3 ↓ +2HClO |
|
| 35. | 详细信息 | ||||||||||||||||||
|
几种短周期元素的原子半径及主要化合价见下表:
根据表中信息,判断以下说法正确的是 A . 单质与稀硫酸反应的速率快慢: R > Y > X B . 离子半径: X 2+ < T 2- C . 元素最高价氧化物对应的水化物的碱性: Y > R > X D . 离子的还原性: Z 2- > T 2- |
|||||||||||||||||||
| 36. | 详细信息 |
|
如图是元素周期表的一部分,下列说法中正确的是 A . 原子半径: ④>⑤ B . 气态氢化物的稳定性: ③大于⑥ C . 元素 ⑤的单质与元素②的最高价氧化物对应的水化物反应时,参加反应的元素⑤的单质与生成氢气的物质的量之比为 2 : 3 D . 元素 ④⑦⑨的单质的氧化性依次减弱 |
|
| 37. | 详细信息 | ||||||||||||||||||||||||||||
|
已知: ① X 、 Y 、 Z 、 W 、 R 、 Q 为原子序数依次增大的短周期元素。 X 是所有元素中原子半径最小的元素, Y 是形成化合物种类最多的元素, W 的最外层电子数是次外层电子数的 3 倍, Q 与 W 同主族, Y 、 R 原子的最外层电子数之和等于 Z 的最外层电子数。 ②莱纳斯卡尔鲍林在 1932 年提出 electronegativity 作为元素原子在化合物中某种性质的标度, electronegativity 的大小可以判断元素金属性与非金属性强弱,下表列出部分短周期元素的 electronegativity 的值。
请回答下列问题 ( 涉及 X 、 Y 、 Z 、 W 、 R 、 Q 时,用元素符号表示 ) : (1) 根据上表给出的数据,可知元素的 electronegativity 越大, _______ ( 填 “ 金属性 ” 或 “ 非金属性 ”) 越强。 (2) 元素 Q 在周期表中的位置为 _______ 。 (3)W 、 R 、 Q 单核简单离子半径由大到小排列顺序为 _______ ( 用微粒符号表示 ) 。 (4) 元素 X 、 Z 、 W 之间能形成多种 10 电子微粒,请写出反应物和产物均为 X 、 Z 、 W 之间形成的 10 电子微粒的一个离子方程式 _______ 。 (5) 一种由元素 W 、 R 组成的淡黄色固体化合物,其电子式为 _______ 。 (6) 试比较下列物质的稳定性: X 2 W _______ X 2 Q ;沸点: X 2 W _______ X 2 Q ( 填 “ < ” 或 “ > ”) 。 (7) 元素 X 、 Y 、 Z 、 W 、 R 、 Q 中的两种元素可形成原子个数比为 1 ∶ 2 的共价化合物,则这两种元素的原子序数之差不可能是 _______ 。 A . 2 B . 4 C . 7 D . 8 |
|||||||||||||||||||||||||||||
| 38. | 详细信息 | |||||||||||||||||||||||||||||||||||||||||||||
|
如表为元素周期表的一部分,请回答有关问题:
(1) 已知元素 ⑩的一种核素,其中子数为 45 ,用原子符号表示该核素为 ___ 。 (2) 由元素 ②和④形成的三核直线形分子的结构式为 ___ 。 (3) 由上述元素 ①和④形成的一种绿色氧化剂的电子式为 ___ ,该化合物所含的化学键类型为 ___ ( 填 “ 离子键 ” 、 “ 极性键 ” 或 “ 非极性键 ”) 。 (4) 若将元素 ④和⑤组成的一种淡黄色固体投入到含有下列离子的溶液中: (5) 能比较元素 ⑦和⑧非金属性强弱的实验事实是 __ ( 填字母序号 ) 。 a . ⑦的氢化物的酸性比⑧的氢化物的酸性弱 b . ⑧的单质 R 2 与 H 2 化合比 ⑦的单质 Q 与 H 2 化合容易,且 HR 的稳定性比 H 2 Q 强 c .在 ⑦的氢化物 H 2 Q 的水溶液中通少量 ⑧的单质 R 2 气体可置换出单质 Q |
||||||||||||||||||||||||||||||||||||||||||||||
| 39. | 详细信息 |
|
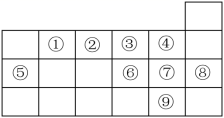
如图是元素周期表的一部分。表中所列的字母分别代表某一元素。 (1) (2) 写出 (3) 其中含元素 E 化合物是一种白色胶状沉淀,可用于净水,则该物质的化学式为 ___________ ; (4) |
|
| 40. | 详细信息 | ||||||||||||||||||||||||||||||||||||
|
下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
(1)11 种元素中,化学性质最不活泼的是 ___________ ,原子半径最大的是 ___________ 。 (2) ①②⑤中,最高价氧化物的水化物中碱性最强的是 ___________ 。 (3) ⑦ ⑪ 中形成的简单离子半径由大到小的顺序是 ___________ 。 (4) ①和⑨的最高价氧化物对应的水化物化学式为 ___________ 和 ___________ 。 ①和⑨两元素形成化合物,该化合物灼烧时焰色颜色为 ___________ 。 (5) ⑧⑨ ⑪ 三种元素形成的气态氢化物最稳定的是 ___________ 。 (6) 上述元素形成在氧化物中,具有两性的是 ___________ ,写出它与氢氧化钠溶液反应的离子方程式 ___________ 。 |
|||||||||||||||||||||||||||||||||||||
| 41. | 详细信息 | |||||||||||||||||||||
|
根据元素周期表中短周期的下列内容,用对应的化学符号回答问题:
(1) 元素 ①~⑨形成的单质中,化学性质最稳定的是 ___________ 。 ④在元素周期表中的位置是 ___________ , ⑥的简单离子的结构示意图为 ___________ 。 (2) ③、⑨和 H 元素可形成一种常见的盐,其电子式为 ___________ ,其中存在的化学键类型为 ___________ 。 ⑤和⑧元素形成化合物的电子式为 ___________ 。 (3) ⑧的一种核素原子的中子数与其核外电子数相同,则该原子是 ___________ 。 ⑧、⑨元素最高价氧化物对应的水化物中,酸性最强的是 ___________ 。 (4) 写出一个可证明 ②和⑦非金属性强弱的离子方程式: ___________ 。 (5) 单质 ②与⑧对应的最高价氧化物的水化物的浓溶液反应的化学方程式: ___________ 。 |
||||||||||||||||||||||
| 42. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
请参照元素 A-H 在元素周期表中位置回答下列问题。
(1) 元素 G 的原子结构示意图 ________ 。 (2) 由 A 、 E 组成的化合物中 A 的化合价为 _______ ,将其投入水中,剧烈反应产生大量气体,反应方程式为 ____________ 。 (3)H 位于元素周期表的 _____ 族, H 与 C 形成的红棕色化合物能与 F 单质发生反应,化学方程式为 _________ ,写出该反应的一种用途 _______ 。 (4)G 的低价氧化物可用于工业制溴过程中吸收潮湿空气中的 Br 2 ,解决了环保问题。写出该反应的化学方程式: __________ 。 (5)BA 3 能与 C 2 在催化剂下发生反应,化学方程式为 ____________ ,如果是纯净的 C 2 , BA 3 则可燃烧,避免污染,化学方程式为 ________ 。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 43. | 详细信息 | ||||||||
|
现有部分短周期元素的性质或原子结构如表:
(1) 元素 X 的一种同位元素可测定文物年代,这种同位素的符号是 ___________ ( 用元素符号表示 ) ,元素 Z 的离子结构元意图为 ___________ 。 (2) 元素 Y 与氢元素形成一离子 YH (3) 元素 X 与元素 Y 相比,非金属性较强的是 ___________ ( 用元素符号表示 ) 。下列表述中能证明这一事实的是 ___________ 。 a .常温下 X 的单质和 Y 的单质状态不同 b . Y 的最高价氧化物对应水化物的酸性比 X 的最高价氧化物对应水化物的酸性强 c . X 与 Y 形成的化合物中 X 元素呈正价状态 (4) 探寻物质的性质差异性是化学学习的重要方法之一、 X 、 Y 、 Z 3 种元素的单质中化学性质明显不同于其他两种单质的是 ___________ ( 用元素符号表示 ) ,理由是 ___________ 。 |
|||||||||
| 44. | 详细信息 |
|
A 、 B 、 C 、 D 、 E 为原子序数依次增大的短周期元素,已知 A 、 B 、 E 3 种原子最外层共有 11 个电子,且这 3 种元素的最高价氧化物的水化物两两皆能发生反应生成盐, C 元素的最外层电子数比次外层电子数少 4 , D 元素原子次外层电子数比最外层电子数多 3 。 (1) 写出下列元素符号: A ___________ , B ___________ , C ___________ , D ___________ , E ___________ (2) 写出 A 与 B 、 B 与 E 两元素最高价氧化物的水化物之间反应的离子方程式: A 与 B : ___________ B 与 E : ___________ (3) 比较 C 、 D 的最高价氧化物的水化物的酸性: ___________ ( 用化学式表示 ) 。 |
|
| 45. | 详细信息 |
|
下表列出了 ①~⑩十种元素在周期表中的位置: 请按要求回答下列问题: (1) 元素 ⑤的原子结构示意图为 ___________ 。 (2) ⑤、⑥、⑨三种元素原子半径由大到小的顺序是 ___________ ( 填元素符号 ) ;这三种元素最高价氧化物对应水化物中碱性最强的是 ___________ ( 填化学式 ) 。 (3) ③、④元素的简单氢化物的稳定性较弱的是 ___________ ( 填化学式 ) 。 (4) 写出 ②的单质与③的最高价氧化物对应的水化物反应的化学方程式: ___________ 。 (5) 写出元素 ⑨的单质与水反应的化学方程式: ___________ 。 (6) 请从原子结构的角度解释,元素 ⑧非金属性比元素⑩强的原因: ___________ 。 |
|
| 46. | 详细信息 |
|
有 7 种短周期元素的原子序数按 A 、 B 、 C 、 D 、 E 、 F 、 G 的顺序依次增大; B 元素一种原子的含量常用于判定古生物遗体的年代, A 和 C 元素的原子能形成 4 核 10 电子的微粒; D 和 E 可形成离子化合物 E 2 D , E 2 D 中所有微粒的电子数相同,且电子总数为 30 ; E 、 F 、 G 的最高价氧化物对应的水化物之间可以相互反应; G 和 D 同主族 . 试回答下列问题: (1)C 元素的原子结构示意图 _______ 。 (2)A 和 D 可形成化合物的化学式为 _______ 。 (3) 过量的 B 元素的最高价氧化物与氢氧化钠溶液反应的离子方程式为 _______ 。 (4)F 的单质与 E 元素的最高价氧化物对应的水化物反应的离子方程式为 _______ 。 (5) 写出 D 元素原子形成的 10 电子微粒 X 与 G 元素原子形成的 18 电子微粒 Y 反应的离子方程式: _______ 。 |
|
| 47. | 详细信息 | ||||||||||||||||||||||||||||||
|
根据表中几种短周期元素的原子半径及主要化合价,回答下列问题:
(1) 元素 C 组成的常见单质有两种,分别是 _______ 、 _______ ( 写名称 ) (2) 用电子式表示 ID 2 的形成过程: _______ 。 (3)A 、 H 、 J 的离子半径由大到小顺序是 _______ ( 用离子符号表示 ) 。 (4)78 gJ 2 B 2 与足量的水反应生成 _______ L( 标准状况下 ) 气体。 (5) 元素 D 的单质与水反应的离子方程式为 _______ 。 |
|||||||||||||||||||||||||||||||
| 48. | 详细信息 |
|
短周期主族元素 A 、 B 、 C 、 D 、 E 的原子序数依次增大。常温下, A 、 B 组成的化合物是常见液体, C 的原子半径是短周期主族元素中最大的, D 最外层电子数等于电子层数的 2 倍。回答下列问题: (1)B 在元素周期表中的位置为 _______ ; A 、 B 组成的原子个数比为 1 : 1 的化合物的电子式为 _______ 。 (2)B 、 C 的简单离子中,半径较大的是 _______ ( 填离子符号 ) ; A 、 B 、 C 三种元素组成的化合物中含有的化学键类型是 _______ 。 (3)C 、 E 的最高价氧化物对应的水化物间反应的化学方程式为 _______ 。 (4) 下列叙述能说明 E 的非金属性强于 D 的是 _______ ( 填序号 ) 。 a.D 的简单氢化物的稳定性弱于 E 的 b.D 的氧化物对应的水化物的酸性弱于 E 的 c.D 的单质常温下为固体, E 的单质常温下为气体 d.E 的单质通入 D 的简单氢化物的水溶液中,有 D 单质生成 |
|
| 49. | 详细信息 |
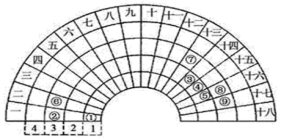
|
元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,思考扇形元素周期表的填充规律,回答下列问题: (1) 元素 ④ 在 “ 标准 ” 长式周期表中的位置 ___________ (2) 元素 ⑤ 的原子结构示意图 ___________ (3) 元素 ②⑤⑧ 形成的简单离子半径由大到小的顺序是 ___________ ( 用化学用语作答 ) (4) 在上述这些元素形成的物质中,其最高价氧化物的水化物中碱性最弱的的是 ___________ ( 写化学式 ) ,氧化性最强的单质是 ___________ ( 写化学式 ) 。 |
|
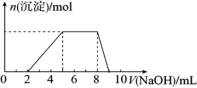
| 50. | 详细信息 |
|
将 (1) 图中 B 点对应溶液中溶质的化学式是: _______ (2) 该氢氧化钠溶液的浓度为: _______ (3) 原合金中镁的质量是: _______ ,铝的质量是 _______ (4) 产生气体体积 (5) 图中 A 点对应氢氧化钠溶液的体积是 _______ 。 |
|