2019-2020年高一上期期中考试化学题开卷有益(宁夏银川一中)
| 1. 选择题 | 详细信息 |
|
下列物质中属于非电解质的是 A.H2SO4 B.NaOH C.Na2CO3 D.蔗糖 |
|
| 2. 选择题 | 详细信息 |
|
鉴别硫酸铜溶液与氢氧化铁胶体最简便的方法是( ) A. 萃取 B. 蒸馏 C. 过滤 D. 丁达尔效应 |
|
| 3. 选择题 | 详细信息 |
|
下列各组混合物中,能用分液漏斗进行分离的是( ) A. 汽油和植物油 B. 水和CCl4 C. 碘和CCl4 D. 酒精和水 |
|
| 4. 选择题 | 详细信息 |
|
在0.5 mol Na2SO4中,含有Na+ 数约是( ) A.0.5 B.1 C.6.02×1023 D.3.01×1023 |
|
| 5. 选择题 | 详细信息 |
|
下列电离方程式错误的是( ) A.HNO3 = H+ + NO3- B.NaHCO3 = Na+ + HCO3- C.BaCl2 = Ba2+ + Cl2- D.Na2SO4 = 2Na+ + SO42- |
|
| 6. 选择题 | 详细信息 |
|
碳酸钠俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是( ) A.碱 B.含氧酸盐 C.钠盐 D.碳酸盐 |
|
| 7. 选择题 | 详细信息 |
|
下列四种基本类型的反应中,一定是氧化还原反应的是 A. 分解反应 B. 置换反应 C. 复分解反应 D. 化合反应 |
|
| 8. 选择题 | 详细信息 |
|
下列实验操作错误的是( ) A. 分液时,先从下口放出下层液体,再从上口倒出上层液体 B. 向试管中滴加液体时,胶头滴管紧贴试管内壁 C. 向容量瓶中转移液体时,用玻璃棒引流 D. 过滤时,漏斗下端紧贴烧杯内壁 |
|
| 9. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.N2的摩尔质量为28g B.标准状况下NH3的体积为22.4L C.17 g NH3的物质的量是1 mol D.22.4 L N2的物质的量为1 mol |
|
| 10. 选择题 | 详细信息 |
|
下列反应的离子方程式,书写错误的是( ) A.氢氧化钠与盐酸反应 OH-+H+=H2O B.用稀硫酸清除铁锈 Fe2O3+6H+=2Fe3++3H2O C.食盐水中滴加硝酸银溶液 Cl-+Ag+=AgCl↓ D.氢氧化钡跟硫酸铜溶液反应 Ba2++SO42-=BaSO4↓ |
|
| 11. 选择题 | 详细信息 |
|
在下列反应中,CO2作氧化剂的是( ) A. C. |
|
| 12. 选择题 | 详细信息 | |||||||||||||||
完成下列实验所需选择的装置或仪器都正确的是( )
|
||||||||||||||||
| 13. 选择题 | 详细信息 |
|
配制250 mL 0.2 mol·L-1的KNO3溶液,需量取4 mol·L-1 KNO3溶液的体积为 ( ) A.125 mL B.50 mL C.12.5 mL D.75 mL |
|
| 14. 选择题 | 详细信息 |
|
下列各组离子中的离子,能在溶液中大量共存的是( ) A.Na+、Mg2+、Cl-、OH- B.H+、Ca2+、CO32-、NO3- C.Cu2+、K+、SO42-、NO3- D.Na+、H+、OH-、Ca2+ |
|
| 15. 选择题 | 详细信息 |
|
下列有关实验操作正确的是( ) A.  B. B.  C.  D. D.  |
|
| 16. 选择题 | 详细信息 |
|
下列现象或应用不能用胶体的知识解释的是( ) A. 清晨,人们经常看到阳光穿过茂密的树木枝叶所产生的美丽景象 B. 土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力 C. 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 D. 水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染 |
|
| 17. | 详细信息 |
|
448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为( ) A. 32g B. 64 C. 64g·mol-1 D. 32 g·mol-1 |
|
| 18. 选择题 | 详细信息 |
|
下列反应不属于四种基本反应类型,但属于氧化还原反应的是( ) A.Fe+CuSO4===FeSO4+Cu B.Fe2O3+3CO C.AgNO3+NaCl===AgCl↓+NaNO3 D.MgCl2(熔融) |
|
| 19. 选择题 | 详细信息 |
|
化学实验时,必须十分重视安全和环保问题。下列操作方法不符合要求的是 A. 少量的浓硫酸溅到皮肤上时,应用大量的水冲洗并涂上3%~5%的NaHCO3溶液 B. 氢气还原氧化铜时为防止氢气损耗应该先加热后通氢气 C. 使用容量瓶、分液漏斗前,先检查是否漏水 D. 给试管中的液体加热时,沿试管倾斜方向不停移动试管或加入碎瓷片,以免液体暴沸伤人 |
|
| 20. 选择题 | 详细信息 |
|
关于氧化还原反应,下列说法正确的是( ) A.失去电子,化合价降低的物质是还原剂 B.被氧化的物质是还原剂 C.氧化剂被氧化,还原剂被还原 D.氧化剂失去电子,化合价升高 |
|
| 21. 选择题 | 详细信息 |
|
在0.5 L某浓度的NaCl溶液中含有0.5 mol NaCl,下列对该溶液的说法中,不正确的是 A. 该溶液溶质的物质的量浓度为1 mol·L-1 B. 该溶液中含有58.5 g NaCl C. 配制100 mL该溶液需用5.85 g NaCl D. 量取100 mL该溶液倒入烧杯中,烧杯中的NaCl物质的量为0.1 mol |
|
| 22. 选择题 | 详细信息 |
|
某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中( ) A.一定有SO42- B.可能有SO42-或Ag+ C.一定无Ag+ D.还可能有CO32- |
|
| 23. 选择题 | 详细信息 |
|
下列关于物质分类及胶体性质描述正确的是( ) A.明矾、空气、硫酸铜均为纯净物 B.熟石灰、烧碱、纯碱都是碱 C.纳米材料粒子直径一般从几纳米到几十纳米,因此纳米材料属于胶体 D.“血液透析”和“静电除尘”分别利用了胶体的不同性质 |
|
| 24. 选择题 | 详细信息 |
|
用 A.在标准状况下, B.常温常压下, C.28g D. |
|
| 25. 选择题 | 详细信息 | |||||||||||||||
对于易燃、易爆、有毒的化学物质,往往会在其包装上贴上危险警告标签。下面所列物质贴错了标签的是( )
|
||||||||||||||||
| 26. 选择题 | 详细信息 |
|
根据反应:①2Fe3++2I-=2Fe2++I2②Br2+2Fe2+=2Fe3++2Br-③Br2+2I-=I2+2Br-,判断离子的还原性由强到弱的顺序正确的是( ) A. Br-、Fe2+、I- B. I-、Fe2+、Br- C. Br-、I-、Fe2+ D. Fe2+、I-、Br- |
|
| 27. 选择题 | 详细信息 |
|
下列反应能用离子方程式H++OH-=H2O表示的是( ) A.澄清石灰水和稀硝酸反应 B.H2SO4溶液与Ba(OH)2溶液反应 C.氢氧化镁和稀盐酸反应 D.CH3COOH溶液与NaOH溶液反应 |
|
| 28. 选择题 | 详细信息 |
|
水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+XOH- =Fe3O4+S4O62-+2H2O,下列说法正确的是( ) A. 硫元素被氧化,铁元素被还原 B. Fe2+、S2O32- 都是还原剂 C. X=2 D. 每生成1mol Fe3O4,则转移电子数2mol |
|
| 29. 选择题 | 详细信息 |
|
某试剂瓶上贴有如下标签“100mL 1.0mol•L﹣1MgCl2 溶液”,对该试剂理解正确的是( ) A.该溶液中含有的微粒主要有:MgCl2、Mg2+、Cl﹣、H2O B.若取 50mL 溶液,其中的 c(Cl﹣)=1 mol•L﹣1 C.取该溶液 5.0 mL 恰好与 0.1 mol•L﹣1 AgNO3100 mL 溶液完全反应 D.该溶液与 100mL 1.0 mol•L﹣1 NaCl 溶液中的 c(Cl﹣)相等 |
|
| 30. 选择题 | 详细信息 |
|
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其中c(H+)=0.1mol/L,c(Al3+)=0.4mol/L,c(SO42—)= 0.8mol/L,则c(K+)为 A.0.3mol/L B.0.2mol/L C.0.15mol/L D.0.4mol/L |
|
| 31. 填空题 | 详细信息 |
|
有以下13种物质,请回答下列问题: ①石墨 ②氧化钠 ③酒精 ④氨水 ⑤二氧化碳 ⑥碳酸氢钠 ⑦氢氧化钡溶液 ⑧冰醋酸 ⑨氯化氢 ⑩硫酸铝 ⑪稀硫酸 ⑫氯化银 ⑬硫酸氢钠 (1)其中能导电的是 _________; 属于电解质的是 _________;属于非电解质的是 _________。 (2)写出物质⑬溶于水的电离方程式:__________________。物质⑬属于________(填“酸”、“碱”或“盐”)。 (3)写出物质⑦和⑪反应的离子方程式:___________________。 (4)写出物质⑥和⑨在水中发生反应的离子方程式:_____________________。 |
|
| 32. 填空题 | 详细信息 |
|
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。 (1)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原 反应的关系”可用如图表达。 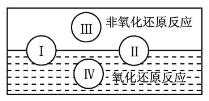 试写出有水参加的符合反应类型Ⅳ的一个化学方程式:_____________________________,其中水为________剂。 (2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:___CuO+____NH4Cl ①配平此氧化还原反应方程式。 ②该反应中,被氧化的元素是______(填元素名称),氧化剂是________(填化学式)。 ③反应中若产生0.2mol的气体,则有________mol的电子转移。 |
|
| 33. 填空题 | 详细信息 |
|
计算填空: (1)______mol CO2中含有氧原子数跟1.806×1024个H2O分子含有的氧原子数相同。 (2)3.01×1023个H2O所含电子的物质的量为________mol。 (3)某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为______,可知所配成的盐酸溶液的物质的量浓度为_____。 (4)标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量为7.60 g,则混合气体中甲烷的体积为______;一氧化碳的质量为_________。 (5)气态化合物A的化学式可以表示为OxFy,已知同温同压下10mLA受热完全分解生成15mLO2和10mL F2,则A的化学式为_____。 (6)将5 mol·L-1的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO |
|
最近更新











