2019-2020年高一前半期期中考试化学试卷(福建省宁德市高中同心顺联盟校)
| 1. 选择题 | 详细信息 |
|
下列科研成果是由我国化学家在化学研究中取得的重要成果的是( ) A. 1869年发现元素周期律,把化学元素及其化合物纳入一个统一理论体系 B. 新一代抗疟药——青蒿素的合成 C. 20世纪现代量子理论化学的建立 D. 1918年发明氨的工业合成方法 |
|
| 2. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.物质的量和摩尔是两个不同的物理量 B.摩尔是物质的量的单位,1摩尔任何物质约含有6.02×1023个原子 C.阿伏加德罗常数数值约为6.02×1023 D.2molNaOH的摩尔质量为1 molNaOH的摩尔质量的两倍 |
|
| 3. 选择题 | 详细信息 |
|
下列说法中,不正确的是( ) ①金属钠、氢气都能在氯气中燃烧,生成白色的烟雾; ②铜丝在氯气中燃烧,生成蓝绿色的氯化铜; ③液氯就是氯气的水溶液,它能使干燥的有色布条褪色; ④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水。 A.①②③④ B.①② C.②③④ D.① |
|
| 4. 选择题 | 详细信息 |
|
下列实验操作中正确的是( ) A.加热液体  B.配制0.1 mol·L-1 NaOH溶液 B.配制0.1 mol·L-1 NaOH溶液 C.稀释浓硫酸  D.往沸水中滴加FeCl3溶液制备Fe(OH)3胶体 D.往沸水中滴加FeCl3溶液制备Fe(OH)3胶体 |
|
| 5. 选择题 | 详细信息 |
|
下列关于氯气和氯水的说法中正确的是( ) A. 氯气是一种无色、密度比空气大的有毒气体 B. 新制氯水保存在无色试剂瓶中 C. 新制氯水能杀菌消毒是因为Cl2有毒,能毒杀细菌 D. 氯水放置数天后酸性增强 |
|
| 6. 选择题 | 详细信息 |
|
下列物质能导电且属于电解质的是 ( ) A.熔融的氢氧化钠 B.氯化氢气体 C.NaCl晶体 D.铜 |
|
| 7. 选择题 | 详细信息 |
|
下列电离方程式中,正确的是( ) A.H2SO4=H2++SO42- B.Ba(OH) 2= Ba2++OH﹣ C.CuSO4=Cu2++SO42- D.NaHCO3=Na++H++CO32- |
|
| 8. 选择题 | 详细信息 |
|
下列事实中,与胶体有关的是( ) A.将植物油倒入水中,用力搅拌形成油水混合物 B.一束平行光线射入鸡蛋清液体里,从侧面可以看到一束光亮的“通路” C.向石灰水中通入二氧化碳气体产生白色浑浊 D.利用活性炭净水 |
|
| 9. 选择题 | 详细信息 |
|
NA为阿伏加德罗常数,下列说法正确的是 A.标准状况下,5.6L氯气和16.8L氧气的混合气体中含有分子数为NA B.标准状况下,22.4LH2O所含有原子数为3NA C.NA个N2分子所占的体积与0.5NA个H2分子所占的体积比一定是2:1 D.1 mo/LNaCl溶液含有2NA个氯离子 |
|
| 10. 选择题 | 详细信息 |
|
下列溶液中Cl-浓度与50 mL 1 mol·L-1AlCl3溶液中Cl-浓度相等的是( ) A. 150 mL 1 mol·L-1的NaCl溶液 B. 75 mL 2 mol·L-1NH4Cl溶液 C. 150 mL 2 mol·L-1的KCl溶液 D. 100 mL 1.5mol·L-1的MgCl2溶液 |
|
| 11. 选择题 | 详细信息 |
|
能够用来鉴别氯化钡、氯化钠、碳酸钠三种溶液的试剂是( ) A. 硝酸银溶液 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸 |
|
| 12. 选择题 | 详细信息 |
|
下列氯化物中,既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是 A. CuCl2 B. MgCl2 C. FeCl3 D. FeCl2 |
|
| 13. 选择题 | 详细信息 |
|
下列各组中的离子,能在溶液中大量共存的是( ) A.Ag+、NO3﹣ 、 K+、Cl- B.NH4+、CO32﹣、Ca2+、Cl- C.OH-、K+、SO42﹣、Na+ D.K+、SO42﹣、Cl- 、Ba2+ |
|
| 14. 选择题 | 详细信息 |
数学中的有些逻辑关系(如下图)对帮助我们理解化学概念很有益处,下列说法正确的是( )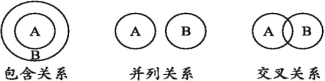 A.强电解质与弱电解质属于交叉关系 B.离子反应与复分解反应属于并列关系 C.胶体与分散系属于包含关系 D.化合物与电解质属于并列关系 |
|
| 15. 选择题 | 详细信息 |
|
下列离子方程式中,书写错误的是( ) A.碳酸钠溶液跟稀硫酸混合: CO32﹣+2H+=H2O+CO2↑ B.硝酸铜溶液中滴加烧碱溶液: Cu2++2OH-=Cu(OH)2↓ C.将CO2通入足量的氢氧化钠溶液中: 2OH-+CO2=CO32﹣+H2O D.硫酸溶液中加入Ba(OH)2溶液: Ba2++ SO |
|
| 16. 选择题 | 详细信息 |
|
下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)( ) A.NaCl=Na++ Cl-  B.盐酸与氢氧化钠溶液反应的实质:H++ NaOH =Na++H2O  C.1 mol H2O中含有的水分子数为6.02×1023 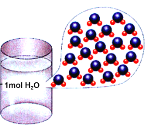 D.熔融的NaCl能够导电:NaCl=Na++ Cl-  |
|
| 17. 综合题 | 详细信息 |
|
I. 以下是日常生活中常见的一些物质:①液氯、②酒精、③CO2、④熟石灰、⑤碳酸钠、⑥稀盐酸、⑦CaO、⑧Na2O2 、⑨Cu,请你指出(填写序号): (1)属于碱性氧化物的是______;能导电的是________。 (2)⑤在水中的电离方程式为____________。 (3)根据以上物质写出一个酸性氧化物与碱溶液反应的离子方程式: __________。 II. 化学计量在化学中占有重要地位.根据计算填空: (1)1.204×1022个HCl分子的物质的量为______,该气体溶于水配制成500 mL的溶液,则溶液中Cl﹣的物质的量浓度为______。 (2)标准状况下体积为44.8LSO2与______g H2所含的分子数相同。 |
|
| 18. 填空题 | 详细信息 |
|
甲型H1N1流感病毒曾在全球广泛传播,给人类健康、社会经济带来了巨大的负面影响。我国采取积极应对措施,使病毒得到了有效的控制,从很大程度上减少了损失,在这里,消毒液功不可没。 (1)生产消毒液是将氯气通入NaOH溶液中,该反应的离子方程式为________。 (2)取少量消毒液滴加AgNO3溶液,现象是出现白色沉淀,说明消毒液中有____离子(写离子符号),该反应的的离子方程式为____________。 (3)消毒液稀释后喷洒在空气中,可以生成具有漂白性的物质,该物质为_________;该物质有漂白性是因为它有强的氧化性,但是它也很不稳定,写出它分解反应的化学方程式:_________。 |
|
| 19. 填空题 | 详细信息 |
|
下面是某同学研究过氧化钠性质过程中的片段。请你帮助他完成部分实验并补全活动记录。 步骤Ⅰ:过氧化钠的颜色、状态:______色,______态。 步骤Ⅱ:类比氧化钠与水反应生成氢氧化钠的反应,过氧化钠与水反应可能有氢氧化钠生成。 步骤Ⅲ:取一只小烧杯,向其中加入少量的过氧化钠固体,然后加入适量的蒸馏水,充分振荡后再向其中滴加酚酞溶液。用手触摸烧杯壁,感觉烫手,得出的结论是_____________;能说明有碱生成的现象是:________,生成的碱是_______;有大量的气泡产生,验证该气体的方法:_____________。 步骤Ⅳ:写出其中过氧化钠分别与水反应的化学方程式:__________________。以上研究物质的过程中没用到的方法是_____。(选项) a.观察法 b.实验法 c.分类法 d.比较法 |
|
| 20. 综合题 | 详细信息 |
|
某同学通过实验研究钠及其化合物的有关性质,请回答相关问题。 (1)实验室中少量的钠通常保存在____中,在实验室中取用钠的仪器是_____。 (2)将金属钠投入水中,发生反应的离子方程式为______________________。 (3)该同学在实验室欲配制500mL 0.1mol/L NaOH溶液。 ①配制溶液时肯定不需要如下图所示仪器中的_____________(填字母),配制上述溶液还需要用到的玻璃仪器是_____________(填仪器名称)。  ②配制溶液时有如下操作:a.溶解 b.摇匀 c.洗涤 d.冷却 e.称量 f.将溶液移至容量瓶g.定容,实验操作顺序正确的是________。 a. e→a→f→d→c→f→g→b b. e→a→d→f→c→f→g→b c. e→a→f→d→c→f→b→g d. e→a→d→f→c→f→b→g ③该同学将所配制的NaOH溶液进行测定,发现浓度大于0.1mol/L。下列操作会引起所配浓度偏大的是______。 a.烧杯未进行洗涤 b.配制前,容量瓶中有少量蒸馏水 c.往容量瓶转移时,有少量液体溅出 d.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容 e.在容量瓶中定容时俯视容量瓶刻度线 f.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线 ④为中和100mL 2.3 mol·L-1 稀硫酸后显中性,需要加入______L 0.1mol/L NaOH溶液。 |
|
最近更新



