2017ж№–еҢ—й«ҳдёүдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜ—еҸҘжҲ–и°ҡиҜӯйғҪдёҺеҢ–еӯҰзҺ°иұЎжңүе…іпјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ В В AгҖҒвҖңеҝҪй—»жө·дёҠжңүд»ҷеұұпјҢеұұеңЁиҷҡж— зјҘзјҲй—ҙвҖқжҳҜдёҖз§ҚиҮӘ然зҺ°иұЎпјҢдёҺиғ¶дҪ“зҹҘиҜҶжңүе…і В В BгҖҒвҖңиҗҪжұӨиһғиҹ№зқҖзәў В В CгҖҒвҖңж»ҙж°ҙзҹіз©ҝпјҢз»ій”ҜжңЁж–ӯвҖқдёҚеҢ…еҗ«еҢ–еӯҰеҸҳеҢ– В В DгҖҒвҖңйҮҺзҒ«зғ§дёҚе°ҪпјҢжҳҘйЈҺеҗ№еҸҲз”ҹвҖқеҢ…еҗ«дәҶеӨҡз§ҚеҢ–еӯҰ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁеҲҶзұ»жӯЈзЎ®зҡ„жҳҜ В В AгҖҒSO2гҖҒSiO2гҖҒCOеқҮдёәй…ёжҖ§ж°§еҢ–зү© В В BгҖҒзЁҖиұҶжөҶгҖҒзЎ…й…ёгҖҒж°ҜеҢ–й“Ғжә¶ж¶ІеқҮдёәиғ¶дҪ“ В В CгҖҒзғ§зўұгҖҒеҶ°йҶӢй…ёгҖҒеӣӣж°ҜеҢ–зўіеқҮдёәз”өи§ЈиҙЁ В В DгҖҒзҰҸ尔马жһ—гҖҒж°ҙзҺ»з’ғгҖҒж°Ёж°ҙеқҮдёәж··еҗҲзү©
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮжңүе…іиҚүй…ёпјҲHOOCвҖ”COOHпјүзҡ„дёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ В В AгҖҒ9.0gиҚүй…ёдёӯе…ұз”Ёз”өеӯҗеҜ№ж•°зӣ®дёә0.9NA В В BгҖҒ9.0gиҚүй…ёиў«NaClOж°§еҢ–з”ҹжҲҗCO2пјҢиҪ¬з§»зҡ„з”өеӯҗж•°дёә0.2 NA В В CгҖҒ9.0gиҚүй…ёжә¶дәҺж°ҙпјҢе…¶дёӯC2O В В DгҖҒ9.0gиҚүй…ёеҸ—зғӯе®Ңе…ЁеҲҶи§ЈдёәCO2гҖҒCOгҖҒH2OпјҢж ҮеҮҶзҠ¶еҶөдёӢжөӢеҫ—з”ҹжҲҗзҡ„ж°”дҪ“дҪ“з§Ҝдёә4.48L
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёәиҫҫеҲ°йў„жңҹзҡ„е®һйӘҢзӣ®зҡ„пјҢдёӢеҲ—ж“ҚдҪңжӯЈ гҖҖВ AгҖҒж¬Ій…ҚеҲ¶иҙЁйҮҸеҲҶж•°дёә10пј…зҡ„ZnSO4жә¶ж¶ІпјҢе°Ҷ10 g ZnSO4В·7H2Oжә¶и§ЈеңЁ90gж°ҙдёӯ
гҖҖВ CгҖҒдёәйүҙеҲ«KClгҖҒAlCl3е’ҢMgCl2жә¶ж¶ІпјҢеҲҶеҲ«еҗ‘дёүз§Қжә¶ж¶Ідёӯж»ҙеҠ NaOHжә¶ж¶ІиҮіиҝҮйҮҸ гҖҖВ DгҖҒдёәеҮҸе°Ҹдёӯе’Ңж»ҙе®ҡиҜҜе·®пјҢй”Ҙ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘSO32-зҡ„иҝҳеҺҹжҖ§еӨ§дәҺIпјҚзҡ„иҝҳеҺҹжҖ§пјҢжҹҗж— иүІжә¶ж¶ІдёӯеҸҜиғҪеҗ«жңүIпјҚгҖҒNH4+гҖҒCu2пјӢгҖҒSO32-пјҢеҗ‘иҜҘжә¶ж¶ІдёӯеҠ е…Ҙе°‘йҮҸжәҙж°ҙпјҢжә¶ж¶Ід»Қе‘Ҳж— иүІпјҢеҲҷдёӢеҲ—е…ідәҺжә¶ж¶Із»„жҲҗзҡ„еҲӨж–ӯжӯЈзЎ®зҡ„жҳҜ в‘ иӮҜе®ҡдёҚеҗ«IпјҚпјӣв‘ЎиӮҜе®ҡдёҚеҗ«Cu2пјӢпјӣв‘ўиӮҜе®ҡеҗ«жңүSO32-пјӣв‘ЈеҸҜиғҪеҗ«жңүIпјҚ AпјҺв‘ в‘ўВ В В В В В В В В BпјҺв‘ в‘Ўв‘ўВ В В В В В В В В CпјҺв‘ўв‘ЈВ В В В В В В В В В DпјҺв‘Ўв‘ўв‘Ј
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—д№ҰеҶҷзҡ„зҰ»еӯҗж–№зЁӢејҸдёӯпјҢжӯЈзЎ®зҡ„жҳҜ В В AгҖҒй«ҳй”°й…ёй’ҫжә¶ж¶ІдёҺд№ҷдәҢй…ёпјҲиҚүй…ёпјүеҸҚеә” В В BгҖҒеңЁNH4HSO4жә¶ж¶Ідёӯзј“ж…ўж»ҙе…Ҙеҗ«зӯүзү©иҙЁзҡ„йҮҸзҡ„NaOHзҡ„жә¶ж¶ІпјҡNH В В CгҖҒVO2+дёҺй…ёжҖ§й«ҳй”°й’ҫжә¶ж¶ІеҸҚеә”пјҡ5VO2++MnO В В DгҖҒFe2+ иў«з©әж°”ж°§еҢ–пјҡ4Fe2+ +O2+2H2O == 4Fe3+ +4OHвҖ”
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘCu2SдёҺдёҖе®ҡжө“еәҰзҡ„HNO3еҸҜеҸ‘з”ҹд»ҘдёӢеҸҚеә”пјҡ 3Cu2S+26HNO3==3CuSO4+3Cu(NO3)2 +15NO2вҶ‘+5NOвҶ‘+13H2OпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ В В AгҖҒCu2 Sж—ўжҳҜиҝҳеҺҹеүӮпјҢеҸҲжҳҜж°§еҢ–еүӮ В В BгҖҒ3 mol Cu2 SеҸ‘з”ҹеҸҚеә”пјҢжңү24molз”өеӯҗиҪ¬з§» В В CгҖҒдә§зү©дёӯеҸӘжңүCuSO4жҳҜж°§еҢ–дә§зү© В В DгҖҒеҸӮеҠ еҸҚеә”зҡ„HNO3дёӯжңү10/13дҪңж°§еҢ–еүӮ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зү©иҙЁзӣёдә’ж··еҗҲеҸҚеә”еҗҺпјҢж—ўжңүж°”дҪ“з”ҹжҲҗпјҢжңҖз»ҲеҸҲжңүжІүж·Җз”ҹжҲҗзҡ„жҳҜ В В в‘ йҮ‘еұһй’ жҠ•е…ҘFeCl3жә¶ж¶Ідёӯ В В в‘ЎиҝҮйҮҸNaOHжә¶ж¶Іе’ҢжҳҺзҹҫжә¶ж¶Іж··еҗҲ В В в‘ўе°‘йҮҸC В В в‘ЈNa2O2жҠ•е…ҘCuCl2жә¶ж¶Ідёӯ В В AгҖҒеҸӘжңүв‘ в‘ЈВ В В В В В В В В BгҖҒеҸӘжңүв‘ўВ В В В В В В В В В CгҖҒеҸӘжңүв‘Ўв‘ўВ В В В В В В В DгҖҒеҸӘжңүв‘ в‘ўв‘Ј
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
вҖңзҘһиҲҹвҖқеҚҒдёҖеҸ·жүҖз”ЁеҠЁеҠӣзҮғж–ҷд№ӢдёҖдёәLiHпјҢе·ІзҹҘдёӢеҲ—еҸҚеә”пјҡ в‘ 2Li(s) +H2(g) == 2LiH(s)В В В В В в‘Ў2H2(g) +O2(g) ==2 H2O(l)В В В В В В в‘ў еҲҷж°ўеҢ–й”ӮеңЁO2дёӯзҮғзғ§зҡ„зғӯеҢ–ж–№зЁӢејҸдёә AгҖҒ2LiH(s) + O2(g) == Li2O(s) +H2O(l)В В В BгҖҒ2LiH(s) + O2(g) == Li2O(s) +H2O(l)В В В CгҖҒ2LiH(s) + O2(g) == Li2O(s) +H2O(l)В В В DгҖҒ2LiH(s) + O2(g) == Li2O(s) +H2O(g)В В В
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
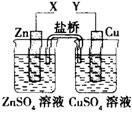
жӯЈзЎ®зҡ„жҳҜ В В AгҖҒXе’ҢYдёҺз”өжөҒиЎЁиҝһжҺҘпјҢз”өеӯҗз”ұCuжһҒжөҒеҗ‘ZnжһҒ В В BгҖҒXе’ҢYдёҺз”өжөҒиЎЁиҝһжҺҘпјҢе°ҶZnжҚўжҲҗFeжөӢеҫ—з”өжөҒжӣҙеӨ§ В В CгҖҒXе’ҢYеҲҶеҲ«дёҺз”өжәҗвҖң-вҖқгҖҒвҖң+вҖқжһҒзӣёиҝһпјҢCuжһҒиҙЁйҮҸеҮҸиҪ» В В DгҖҒXе’ҢYеҲҶеҲ«дёҺз”өжәҗвҖң-вҖқгҖҒвҖң+вҖқжһҒзӣёиҝһпјҢZnжһҒиҙЁйҮҸеҮҸиҪ»
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
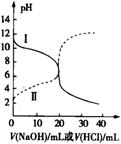
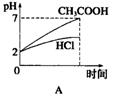
еңЁдҪ“з§ҜеқҮдёә1LгҖҒpHеқҮзӯүдәҺ2зҡ„зӣҗй…ёе’ҢйҶӢй…ёжә¶ж¶ІдёӯпјҢеҲҶеҲ«жҠ•е…Ҙ0.23g NaпјҢеҲҷдёӢеӣҫдёӯжҜ”иҫғз¬ҰеҗҲеҸҚеә”дәӢе®һзҡ„жӣІзәҝжҳҜ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүдҪ“з§ҜеқҮдёә25mLпјҢзү©иҙЁзҡ„йҮҸжө“еәҰеқҮдёә0.1molВ·LвҖ”1зҡ„дёӢеҲ—жә¶ж¶Іпјҡв‘ Na2CO3жә¶ж¶ІгҖҒв‘ЎCH3COONaжә¶ж¶ІгҖҒв‘ўNaOHжә¶ж¶ІпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AгҖҒдёүз§Қжә¶ж¶ІpHзҡ„еӨ§е°ҸйЎәеәҸжҳҜв‘ў>в‘Ў>в‘ BгҖҒиӢҘе°Ҷ CгҖҒиӢҘеҲҶеҲ«еҠ е…Ҙ25mL0.1molВ·LвҖ”1зӣҗй…ёеҗҺпјҢpHжңҖеӨ§зҡ„жҳҜв‘ DгҖҒиӢҘдёүз§Қжә¶ж¶Ізҡ„PHеқҮдёә9пјҢеҲҷзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„еӨ§е°ҸйЎәеәҸв‘ў>в‘ >в‘Ў
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
25в„ғж—¶пјҢеҸ–жө“еәҰеқҮдёә0.1molВ·LвҖ”1зҡ„йҶӢй…ёжә¶ж¶Іе’Ңж°Ёж°ҙеҗ„20mLпјҢеҲҶеҲ«з”Ё0.1molВ·LвҖ”1 NaOHжә¶ж¶ІгҖҒ0.1molВ·LвҖ”1зӣҗй…ёиҝӣиЎҢдёӯе’Ңж»ҙе®ҡпјҢж»ҙе®ҡиҝҮзЁӢдёӯpHйҡҸж»ҙеҠ жә¶ж¶Ізҡ„дҪ“з§ҜеҸҳеҢ–е…ізі»еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AгҖҒжӣІзәҝIпјҢж»ҙеҠ 10mLжә¶ж¶Іж—¶пјҡc(CH3COвҖ”)>C(Na+)>c(H+)>c(OHвҖ”) BгҖҒжӣІзәҝIпјҢж»ҙеҠ 20mLжә¶ж¶Іж—¶пјҡc(ClвҖ”)=c(NH CгҖҒжӣІзәҝIIпјҢжүҖж»ҙеҠ жә¶ж¶ІеңЁ10mL~20mLд№Ӣй—ҙж—¶еӯҳеңЁпјҡ c(NH DгҖҒжӣІзәҝIIпјҢж»ҙеҠ 10mLжә¶ж¶Іж—¶пјҡ c(CH3COOвҖ”)
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
ж ҮеҮҶзҠ¶еҶөдёӢжңүв‘ 6.72LCH4пјӣв‘Ў3.01Г—1023дёӘHClпјӣв‘ў13.6gH2S(g)пјӣв‘Ј0.2molNH3(g)гҖӮдёӢеҲ—еҜ№еӣӣз§Қж°”дҪ“зҡ„е…ізі»д»Һе°ҸеҲ°еӨ§иЎЁзӨәдёҚжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (В В В ) В В В A. дҪ“з§Ҝпјҡв‘Ј<в‘ <в‘ў<в‘ЎВ В В В В В В В В В В В В В B. еҜҶеәҰпјҡв‘ <в‘Ј<в‘ў<в‘Ў C. иҙЁйҮҸпјҡв‘Ј<в‘ <в‘ў<в‘ЎВ В В В В В В В В В В В В В D. ж°ўеҺҹеӯҗж•°пјҡв‘Ј<в‘Ў<в‘ў<в‘
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
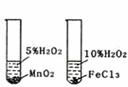
еҲ©з”ЁеҸідёӢеӣҫжүҖзӨәиЈ…зҪ®иҝӣиЎҢдёӢеҲ—е®һйӘҢпјҢиғҪеҫ—еҮәзӣёеә”е®һйӘҢз»“и®әзҡ„жҳҜ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
дёҖе®ҡжё©еәҰдёӢпјҢеңЁе®№з§Ҝдёә2Lзҡ„еҜҶй—ӯе®№еҷЁдёӯеҸ‘з”ҹеҸҚеә”CO(g)+H2O(g) == CO2(g)+H2(g)пјҢйғЁеҲҶж•°жҚ®и§ҒдёӢиЎЁпјҲиЎЁдёӯ
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AгҖҒеҸҚеә”еңЁ BгҖҒе№іиЎЎж—¶COзҡ„иҪ¬еҢ–зҺҮдёә66.67% CгҖҒиҜҘжё©еәҰдёӢеҸҚеә”зҡ„е№іиЎЎеёёж•°дёә1 DгҖҒе…¶д»–жқЎд»¶дёҚеҸҳпјҢиӢҘиө·е§Ӣж—¶n(CO)=0.60molпјҢn(H2O)=1.20molпјҢеҲҷе№іиЎЎж—¶n(CO2
|
|||||||||||||||||||||
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
ж №жҚ®MgдёҺCO2зҡ„еҸҚеә”жҺЁжөӢпјҢNaд№ҹиғҪеңЁCO2дёӯзҮғзғ§пјҢдё”еӣәдҪ“дә§зү©еҸҜиғҪдёәCгҖҒNa2Oе’ҢNa2CO3дёӯзҡ„дёӨз§ҚжҲ–дёүз§ҚгҖӮжҹҗе…ҙи¶Је°Ҹз»„з”ЁеҰӮдёӢиЈ…зҪ®ејҖеұ•дёӨдёӘйҳ¶ж®өзҡ„е®һйӘҢжҺўз©¶гҖӮ
гҖҗе®һйӘҢIгҖ‘еј•еҸ‘CO2дёҺNaеҸҚеә”гҖӮж“ҚдҪңжӯҘйӘӨдёәпјҡ в‘ жҢүеӣҫиҝһжҺҘиЈ…зҪ®пјҢжЈҖйӘҢиЈ…зҪ®ж°”еҜҶжҖ§пјҢ并еҫҖеҗ„иЈ…зҪ®дёӯеҠ е…ҘиҜ•еүӮпјӣВ В В В В В в‘Ўжү“ в‘ўзӮ№зҮғdеӨ„й…’зІҫзҒҜпјҢдҪҝCO2дёҺNaе……еҲҶеҸҚеә”гҖӮеҒңжӯўеҠ зғӯпјҢ继з»ӯйҖҡж°”дҪ“дҪҝеҸҢйҖҡз®ЎеҶ·еҚҙгҖӮ еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүиЈ…зҪ®aдёӯз”ЁеҲ°зҡ„зҺ»з’ғд»ӘеҷЁжңүиҜ•з®Ўе’ҢВ В В В В В В В В В В В В В В В В В В В В В пјӣ пјҲ2пјүиЈ…зҪ®bдёӯиЈ…е…Ҙзҡ„иҜ•еүӮжҳҜгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖВ В В В В В В В В В пјӣ пјҲ3пјүиЈ…зҪ®cзҡ„дҪңз”ЁжҳҜгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖВ В В В В В В В В В пјӣ пјҲ4пјүжӯҘйӘӨв‘ЎдёӯпјҢеҪ“и§ӮеҜҹеҲ°гҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖВ В В В В В В В В В В В В В В В ж—¶пјҢжүҚиғҪиҝӣе…ҘжӯҘйӘӨв‘ўгҖӮ гҖҗе®һйӘҢв…ЎгҖ‘жҺўз©¶еҸҚеә”дә§зү©еҸҠеҸҚеә”жңәзҗҶгҖӮеҸ–еҸҚеә”еҗҺеҸҢйҖҡз®ЎдёӯеӣәдҪ“зү©иҙЁ29.2 gиҝӣиЎҢеҰӮдёӢе®һйӘҢпјҡ в‘ д»”з»Ҷи§ӮеҜҹеӣәдҪ“пјҢеҸ‘зҺ°жңүй»‘иүІйў—зІ’пјӣ в‘Ўе°ҶеӣәдҪ“жә¶дәҺи¶ійҮҸзҡ„ж°ҙ并иҝҮж»ӨгҖҒжҙ—ж¶ӨпјҢеҫ—еҲ°1.8 gж»ӨжёЈпјҲе№ІзҮҘпјүпјӣ в‘ўе°Ҷж»Өж¶ІеҠ ж°ҙзЁҖйҮҠй…ҚжҲҗ250 mLзҡ„жә¶ж¶Іпјӣ в‘ЈеҸ–е°‘йҮҸв‘ўзҡ„жә¶ж¶ІпјҢе…ҲеҠ и¶ійҮҸBaCl2жә¶ж¶ІпјҢи§ӮеҜҹеҲ°зҷҪиүІжІүж·Җ,жүҖеҫ—еӣәдҪ“иҙЁйҮҸдёә3.94gпјӣеҶҚеҠ еҮ ж»ҙй…ҡй…һиҜ•ж¶ІпјҢжә¶ж¶ІеҸҳзәўпјӣ в‘ӨеҸ–25.00 mLв‘ўзҡ„жә¶ж¶ІпјҢж»ҙеҠ з”Іеҹәж©ҷдҪңдёәжҢҮзӨәеүӮпјҢз”Ё3.0 molВ·L-1зӣҗй…ёж»ҙе®ҡпјҢж¶ҲиҖ—зӣҗй…ёдҪ“з§Ҝдёә20.00 mLгҖӮ еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ5пјүеҰӮдҪ•еҲӨж–ӯв‘Өдёӯзҡ„ж»ҙе®ҡз»ҲзӮ№гҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖВ В В В В В В В В В В В В В В В В В В пјҲ6пјүеҸҚеә”еҗҺиЈ…зҪ®dдёӯзҡ„еӣәдҪ“
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
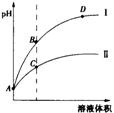
е·ІзҹҘH2CO3зҡ„ пјҲ1пјүеҗ‘NaClOжә¶ж¶ІдёӯйҖҡе…Ҙе°‘йҮҸдәҢж°§еҢ–зўіж—¶еҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ дёәВ В В В В В В В В В В В гҖӮ пјҲ2пјүеёёжё©дёӢпјҢе°ҶpHе’ҢдҪ“з§ҜйғҪзӣёеҗҢзҡ„ж°ўж°ҹй…ёе’Ңж¬Ўж°Ҝй…ёеҲҶеҲ«еҠ и’ёйҰҸж°ҙзЁҖйҮҠпјҢpHйҡҸжә¶ж¶ІдҪ“з§Ҝзҡ„еҸҳеҢ–еҰӮеӣҫжүҖзӨәгҖӮ В в‘ жӣІзәҝIдёәВ В В В В В В В зЁҖйҮҠж—¶pHзҡ„еҸҳеҢ–жӣІзәҝгҖӮ В в‘ЎеҸ–AзӮ№еӨ„зҡ„дёӨз§Қй…ёзҡ„жә¶ж¶ІпјҢдёӯе’ҢзӣёеҗҢдҪ“з§ҜгҖҒзӣёеҗҢжө“еәҰзҡ„NaOHжә¶ж¶ІпјҢж¶ҲиҖ—В В В В В В В жә¶ж¶Ізҡ„дҪ“з§Ҝиҫғе°ҸгҖӮ В в‘ўBзӮ№жә¶ж¶Ідёӯж°ҙзҡ„з”өзҰ»зЁӢеәҰВ В В В В В В В В пјҲеЎ«вҖң>вҖқгҖҒвҖң=вҖқжҲ–вҖң<вҖқпјүCзӮ№жә¶ж¶Ідёӯж°ҙзҡ„з”өзҰ»зЁӢеәҰгҖӮ пјҲ3пјү25в„ғж—¶пјҢе°Ҷ0.40molВ·LвҖ”1 HCNжә¶ж¶ІдёҺ0.20molВ·LвҖ”1 NaOHжә¶ж¶Іеҗ„100mLж··еҗҲеҗҺпјҢжөӢеҫ—жә¶ж¶Ізҡ„ В В В В В В В В В В В molВ·LвҖ”1 пјҢc(CNвҖ”)-c(HCN)=В В В В В В В В В В molВ·LвҖ”1 гҖӮ(еҒҮи®ҫж··еҗҲеҗҺзҡ„жә¶ж¶ІжҖ»дҪ“з§ҜдёәдёӨжә¶ж¶ІдҪ“з§Ҝд№Ӣе’Ң) пјҲ4пјүе·ІзҹҘ25в„ғж—¶пјҢ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||
|
дёҖе®ҡжқЎд»¶дёӢй“ҒеҸҜд»Ҙе’ҢCO2еҸ‘з”ҹеҸҚеә”пјҡFe(s)+CO2(g) пјҲ1пјүиҜҘеҸҚеә”зҡ„е№іиЎЎеёёж•°иЎЁиҫҫејҸK=В В В В В В В В В В В В гҖӮ пјҲ2пјүдёӢеҲ—жҺӘж–ҪдёӯиғҪдҪҝе№іиЎЎж—¶KеўһеӨ§зҡ„жҳҜВ В В В В В В В В пјҲеЎ«еәҸеҸ·пјүгҖӮ AгҖҒеҚҮй«ҳжё©еәҰВ В В В В В В В В В В В BгҖҒеўһеӨ§еҺӢејә CгҖҒе……е…ҘдёҖе®ҡйҮҸCOВ В В DгҖҒйҷҚдҪҺжё©еәҰ пјҲ3пјү8minеҶ…пјҢCOзҡ„зҡ„е№іеқҮеҸҚеә”йҖҹзҺҮ пјҲ4пјү1100в„ғж—¶пјҢ2Lзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢжҢүдёҚеҗҢж–№ејҸжҠ•е…ҘеҸҚеә”зү©пјҢдҝқжҢҒжҒ’жё©гҖҒжҒ’е®№пјҢжөӢеҫ—еҸҚеә”иҫҫеҲ°е№іиЎЎж—¶зҡ„жңүе…іж•°жҚ®еҰӮдёӢпјҡ
В В в‘ дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜВ В В В В В В В В гҖӮ В В В В AгҖҒ В В в‘ЎжұӮ
|
|||||||||||||||||||
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҲ1пјүз”Ёй«ҳй“ҒпјҲVIпјүй…ёзӣҗи®ҫи®Ўзҡ„й«ҳй“ҒпјҲVIпјүз”өжұ жҳҜдёҖз§Қж–°еһӢеҸҜе……з”өз”өжұ пјҢз”өи§ЈиҙЁжә¶ж¶ІдёәKOHжә¶ж¶ІпјҢж”ҫз”өж—¶зҡ„жҖ»еҸҚеә”дёә3Zn+2K2FeO4+8H2O == 3Zn(OH)2 + 2Fe(OH)3 +4KOHгҖӮ В В в‘ еҶҷеҮәжӯЈжһҒеҸҚеә”ејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ В В в‘Ўз”Ёй«ҳй“ҒпјҲVIпјүз”өжұ дҪңз”ө (2) в‘ е°Ҷй’’еӮ¬еҢ–еүӮпјҲдё»иҰҒжҲҗеҲҶV2O5пјүдёҺзЁҖзЎ«й…ёгҖҒдәҡзЎ«й…ёй’ҫжә¶ж¶Іж··еҗҲпјҢе……еҲҶеҸҚеә”пјҢжүҖеҫ—жә¶ж¶Іжҳҫй…ёжҖ§пјҢеҗ«VO2+гҖҒK+гҖҒSO в‘Ўеҗ‘дёҠиҝ°жүҖеҫ—жә¶ж¶ІдёӯеҠ е…ҘKClO3жә¶ж¶ІпјҢе……еҲҶеҸҚеә”еҗҺпјҢжә¶ж¶Ідёӯж–°еўһеҠ дәҶVO
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
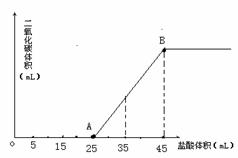
е°Ҷ2.5gзўій…ёй’ гҖҒзўій…ёж°ўй’ е’Ңж°ўж°§еҢ–й’ еӣәдҪ“ж··еҗҲзү©е®Ңе…Ёжә¶и§ЈдәҺж°ҙпјҢеҲ¶жҲҗзЁҖжә¶ж¶ІпјҢ然еҗҺеҗ‘иҜҘжә¶ж¶ІдёӯйҖҗж»ҙеҠ е…Ҙ1mol/Lзҡ„зӣҗй…ёпјҢжүҖеҠ е…Ҙзӣҗй…ёзҡ„дҪ“з§ҜдёҺдә§з”ҹCO2зҡ„дҪ“з§ҜпјҲж ҮеҮҶзҠ¶еҶөпјүе…ізі»еҰӮеӣҫжүҖзӨәпјҡ
пјҲ1пјүOAж®өзҰ»еӯҗж–№зЁӢејҸпјҡ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ пјҲ2пјүеҪ“еҠ е…Ҙ35mLзӣҗй…ёж—¶пјҢдә§з”ҹдәҢж°§еҢ–зўізҡ„дҪ“з§ҜдёәВ В В В В В В В В В В В m пјҲ3пјүи®Ўз®—еҺҹж··еҗҲзү©дёӯNa2CO3зҡ„иҙЁйҮҸеҲҶж•°дёәВ В В В В В В В В В В В гҖӮ
|
|
- ж–°дҪҷеёӮй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- й«ҳдёүеҢ–еӯҰдёҠеҶҢдё“йўҳз»ғд№ иҖғйўҳеҗҢжӯҘи®ӯз»ғ
- 2018иҮі2019е№ҙй«ҳдәҢдёӢеҚҠжңҹ第дёүж¬ЎжңҲиҖғеҢ–еӯҰиҖғйўҳеҗҢжӯҘи®ӯз»ғпјҲиҙөе·һзңҒйҒөд№үиҲӘеӨ©й«ҳзә§дёӯеӯҰпјү
- е®һйӘҢдёӯеӯҰй«ҳдёүеҢ–еӯҰжңҹдёӯиҖғиҜ•пјҲ2018е№ҙдёҠеӯҰжңҹпјүеҗҢжӯҘз»ғд№
- йҷ•иҘҝзңҒе’ёйҳіеёӮе®һйӘҢдёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠеҶҢ第еӣӣж¬ЎжңҲиҖғеҢ–еӯҰеңЁзәҝиҖғиҜ•йўҳе…Қиҙ№з»ғд№
- зҹіе®¶еә„дәҢдёӯе®һйӘҢеӯҰж Ўй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·йўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- дёҠжө·еёӮй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҲиҖғиҜ•еҚ·жЁЎжӢҹиҖғиҜ•з»ғд№
- е№ҝиҘҝеЈ®ж—ҸиҮӘжІ»еҢәеҚ—е®ҒеёӮе…ҙе®ҒеҢәеҚ—е®ҒеёӮ第дёүдёӯеӯҰ2020-2021е№ҙй«ҳдәҢдёҠеҶҢ12жңҲжңҲиҖғеҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·
 В
В 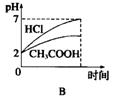 В
В 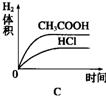 В
В