高一上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列叙述错误的是 A.1mol任何物质都含有约6.02×1023个原子 B.0.012kg12C 含有约6.02×1023个碳原子 C.在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类 D.物质的量是国际单位制中七个基本物理量之一
|
|
| 2. | 详细信息 |
|
分类方法在化学学科的发展中起到了非常重要的作用,下列分类标准合理的是 ①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等 ②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应 ③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 ④根据在水或在熔融条件下能否导电将化合物分为电解质和非电解质 A.①③ B.②④ C.①②④ D.②③④
|
|
| 3. | 详细信息 |
|
下列关于氧化还原反应的叙述,正确的是 A.失去电子的反应是还原反应 B.失去电子的物质是还原剂 C.发生氧化反应的物质是氧化剂 D.作氧化剂的物质不能是还原剂
|
|
| 4. | 详细信息 |
|
等物质的量的钠、镁、铝与足量稀H2SO4反应生成的氢气的物质的量之比是 A.1:1:1 B.1:2:3 C.3:2:1 D.6:3:2
|
|
| 5. | 详细信息 |
|
将4g NaOH溶于水中,若要使每100个H2O分子中含有1个Na+,则需要水的物质的量为 A.0.1 mol B. 1 mol C.10 mol D.100 mol
|
|
| 6. | 详细信息 |
|
在我国许多地区已发生过误食亚硝酸中毒事件。人体正常的血红蛋白中含有Fe2+,若误食亚硝酸盐则导致血红蛋白中Fe2+转化为高价铁血红蛋白而中毒。服用维生素C(Vc)可解除亚硝酸盐中毒。以下说法正确的是 A.Vc将Fe3+还原为Fe2+ B.Vc解毒未发生氧化还原反应 C.亚硝酸盐是还原剂 D.Vc是氧化剂
|
|
| 7. | 详细信息 |
|
将30mL 0.5mol/L NaCl溶液加水稀释到500mL,稀释后溶液中NaCl的物质量浓度为 A.0.03mol/L B.0.3mol/L C.0.05mol/L D. 0.04mol/L
|
|
| 8. | 详细信息 |
|
某元素在化学反应中,由化合态变为游离态,则该元素 A.化合价降低为零 B.一定被还原 C.可能被氧化,也可能被还原 D.一定被氧化
|
|
| 9. | 详细信息 |
|
在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。在同温同压下,两容器内的气体一定具有相同的 A.原子数 B.密度 C.质量 D.质子数
|
|
| 10. | 详细信息 |
|
BaCO3与稀硝酸反应,正确的离子方程式是 A.Ba2++ CO32-+2H+=Ba(NO3)2+ H2O+CO2↑ B.BaCO3+2H++2NO3-= Ba(NO3)2+ H2O+CO2↑ C.BaCO3+2H+= Ba2++ H2O+CO2↑ D.CO32-+2H+= H2O+CO2↑
|
|
| 11. | 详细信息 |
|
将饱和FeCl3溶液滴入沸水并煮沸一段时间,可得到红褐色液体,此液体不具有的性质是 A.光束通过该液体时形成光亮的“通路” B.插入石墨电极通直流电后,有一极附近液体颜色加深 C.向该液体中加入硝酸银溶液,无沉淀产生 D.向该液体中逐滴滴入过量的稀硫酸,会看到液体先生成红褐色沉淀,后沉淀溶解
|
|
| 12. | 详细信息 |
|
能用H++OH-=H2O表示的化学方程式有 A.氢氧化钠溶液与硝酸反应 B.氢氧化铁与硫酸反应 C.氢氧化钡与硫酸反应 D.硫酸氢钠与氢氧化钠溶液反应
|
|
| 13. | 详细信息 |
|
已知某溶液中含有Na+、Ba2+、Fe3+三种阳离子,那么溶液中的阴离子可能是 A.SO42- B.Cl- C.OH- D.NO3-
|
|
| 14. | 详细信息 |
|
体积为V mL、密度为ρ g/cm3的溶液,含有相对分子质量为M的溶质m g,其物质的量浓度为c mol/L,溶质的质量分数为W%,下列表示式中正确的是 A.c= C.W%=
|
|
| 15. | 详细信息 |
|
下列各组化学反应中,盐酸均是反应物。利用盐酸的弱氧化性的是(填编号) __________;利用盐酸的弱还原性的是 _______;仅利用盐酸的酸性的是 _____。 (1)4HCl(浓) + MnO2 △ MnCl2 + Cl2↑ + 2H2O (2) 2HCl + 2Na =2NaCl + H2↑ (3)2HCl + CuO =CuCl2 + H2O (5)CaCO3 +2HCl = CaCl2 + H2O + CO2↑ (6) Fe +2HCl = FeCl2 + H2↑
|
|
| 16. | 详细信息 |
|
下列物质中,物质的量最大的是________,标准状况下体积最大的是________,含原子个数最多的是________,质量最大的是________。 A. 6g H2 B. 0.8mol CO2 C. 1.204×1024个H2S分子 D.147g H3PO4 E.27mL水
|
|
| 17. | 详细信息 |
|
(1)1个12C的质量是a kg,1个Na的质量是b kg,Na的摩尔质量是 。(用含a、b的表达式表示) (2)铝的相对原子质量为27,则其摩尔质量为_____ ____,若阿伏加德罗常数取6.02×1023mol-1,则可估算一个铝原子的质量约为_________ ______g.
|
|
| 18. | 详细信息 |
|
H2S的水溶液不易导电,写出2FeCl3+H2S=2FeCl2+S↓+2HCl的离子方程式是 , 是氧化剂, 是还原剂, 是氧化产物, 是还原产物。
|
|
| 19. | 详细信息 |
|
Na、Mg、Al、Fe四种金属中的两种组成的混合物12 g,与足量的盐酸反应产生0.5 g氢气,则混合物中一定含有的金属是 (写元素名称)
|
|
| 20. | 详细信息 |
|
)已知16g A与20g B恰好完全反应生成Wg C和4.5g D,在相同条件下15g B与8g A反应,生成0. 125 mol C,则C的摩尔质量为
|
|
| 21. | 详细信息 |
|
用18 mol/L的浓硫酸配制80 mL 1.0 mol/L的稀硫酸,需用的实验仪器有:A.100 mL量筒 B.托盘天平 C.玻璃棒 D.50 mL容量瓶 E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶 (1)实验时应选用仪器的先后顺序是(填入编号) . (2)在容量瓶的使用方法中,下列操作不正确的是 (填写标号). A.使用容量瓶前先检查它是否漏水 B.容量瓶用蒸馏水洗净后,再用待配溶液润洗 C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2 cm处,用滴管滴加蒸馏水到标线 D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2 cm处,用滴管滴加蒸馏水到标线 E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次 (3)用量筒取浓硫酸 (4)在G.50 mL烧杯中的操作是如何进行的? __________________________________________________
(5)溶解、冷却,该步实验中需要使用玻璃棒,目的是_____________________________. (6)转移、洗涤.在转移时应使用 引流,需要洗涤烧杯2~3次是为了 _____________________________________________________.
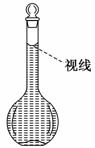
(8)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签, 注明配制的时间、溶液名称及浓度. (9)在配制过程中,某学生观察定容时液面情况如图所示,所配 溶液的浓度会__________(填“偏高”、“偏低”或“无影响”).
|
|
| 22. | 详细信息 |
|
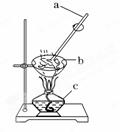
海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.某化学兴趣小组为了从海水中分离出氯化钠,设计了如下实验方案: 海水 (1) 写出步骤Ⅰ中发生反应的离子方程式是 , . (2)步骤Ⅱ中试剂B为_____ ___,加入过量B的目的是________________________. (3)步骤Ⅲ中试剂C为_____ ___,加入适量C至___ _____,其目的是__________________ ______. (4)步骤Ⅳ的实验操作为____ ____,试根据图示回答: ①按顺序写出图中编号仪器的名称: ________________________________________; ②仪器a的作用是_______________,其目的是_______________________________; ③当仪器b中出现___ _____时即可停止加热.
|
|
| 23. | 详细信息 | |||
|
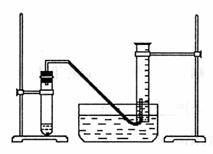
某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL)。实验装置如下:
请回答:(1)进行此实验时,必须保证气密性良好,如何检验此装置的气密性?
。 (2)以下是测量收集到气体体积必须包含的几个步骤:a.调整量筒内外液面高度使之相同;b.使试管和量筒内的气体都冷却至室温;c.读取量筒内气体的体积。这三个操作步骤的正确顺序是(填写代号) 。 (3)测量收集到气体体积时,如何使量筒内外液面的高度相同? 。 进行该操作的目的是___________________________________________ (4)如果实验中得到的氢气体积是VmL(已折算成标准状况),水蒸气的影响忽略不计,锌的摩尔质量的计算式为(含W、V,不必化简):M(Zn)= 。
|
||||