2017зҰҸе»әй«ҳдәҢдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹдёӯиҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
дёӢеҲ—зү©иҙЁеҲҶзұ»з»„еҗҲжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү
|
|||||||||||||||||||||
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺејұз”өи§ЈиҙЁзҡ„иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү В BпјҺйҶӢй…ёжә¶ж¶ІиҫҫеҲ°з”өзҰ»е№іиЎЎж—¶пјҢдёҚеӯҳеңЁCH3COOпјҚ+H+ В CпјҺH2SO4жҳҜе…ұд»·еҢ–еҗҲзү©пјҢжүҖд»Ҙе®ғжҳҜејұз”өи§ЈиҙЁпјӣNaOHжҳҜзҰ»еӯҗеҢ–еҗҲзү©пјҢжүҖд»Ҙе®ғжҳҜејәз”өи§ЈиҙЁ В DпјҺејұз”өи§ЈиҙЁжә¶ж¶ІдёӯпјҢж—ўжңүжә¶иҙЁеҲҶеӯҗпјҢеҸҲжңүжә¶иҙЁз”өзҰ»еҮәжқҘзҡ„зҰ»еӯҗ |
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸдёӯпјҢеұһдәҺж°ҙи§ЈеҸҚеә”зҡ„жҳҜпјҲВ В В В пјү В В AпјҺHCOOH+H2O В В CпјҺSO32вҖ” + H2O |
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢпјҢдёӢеҲ—жә¶ж¶ІpHе°ҸдәҺ7зҡ„жҳҜпјҲВ В В В пјү В В AпјҺCH3COONa В В В В В В В В В В В BпјҺCuSO4В В В В В В В В В В В В В В В CпјҺNaHCO3В В В В В В В В В В В DпјҺKNO3 |
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ25 в„ғж—¶пјҢжҹҗжә¶ж¶Ідёӯз”ұж°ҙз”өзҰ»еҮәзҡ„c(HпјӢ)пјқ1Г—10пјҚ4 molВ·LпјҚ1пјҢеҲҷиҜҘжә¶ж¶Ізҡ„pHеҸҜиғҪжҳҜпјҲВ В В В пјү В В AпјҺ9гҖҖгҖҖгҖҖгҖҖгҖҖгҖҖВ BпјҺ11В В В В В В В В В В В В CпјҺ6В В В В В В В В В В В В В В DпјҺ4 |
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺз”өзҰ»е№іиЎЎеёёж•°пјҲKпјүзҡ„иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү В AпјҺз”өзҰ»е№іиЎЎеёёж•°пјҲKпјүдёҺжё©еәҰж— е…і В В BпјҺH2CO3зҡ„з”өзҰ»еёёж•°иЎЁиҫҫејҸ В В CпјҺеҗҢжё©дёӢпјҢз”өзҰ»е№іиЎЎеёёж•°и¶Ҡе°ҸиЎЁзӨәејұз”өи§ЈиҙЁз”өзҰ»иғҪеҠӣи¶Ҡејұ В В DпјҺеӨҡе…ғејұй…ёеҗ„жӯҘз”өзҰ»е№іиЎЎеёёж•°зӣёдә’е…ізі»дёәпјҡK1<K2<K3 |
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еә”з”ЁдёҺзӣҗзұ»зҡ„ж°ҙи§Јж— е…ізҡ„жҳҜпјҲВ В В В пјү В В AпјҺзәҜзўұжә¶ж¶ІеҸҜеҺ»йҷӨжІ№жұЎВ В В В В В В В В В В В В В В В В В BпјҺFeCl3йҘұе’Ңжә¶ж¶Іж»ҙе…ҘжІёж°ҙдёӯеҲ¶Fe(OH)3иғ¶дҪ“ В В CпјҺжіЎжІ«зҒӯзҒ«еҷЁзҡ„зҒӯзҒ«еҺҹзҗҶВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В DпјҺNaClеҸҜз”ЁдҪңйҳІи…җеүӮе’Ңи°ғе‘іеүӮ |
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺжІүж·Җжә¶и§Је№іиЎЎзҡ„иҜҙжі•дёӯдёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү В В AпјҺйҡҫжә¶з”өи§ЈиҙЁеңЁж°ҙдёӯеӯҳеңЁжІүж·Җжә¶и§Је№іиЎЎпјҢдё”жҳҜдёҖз§ҚеҠЁжҖҒе№іиЎЎ В В BпјҺKspеҸӘдёҺйҡҫжә¶з”өи§ЈиҙЁзҡ„жҖ§иҙЁе’Ңжё©еәҰжңүе…іпјҢдёҺжә¶ж¶ІдёӯзҰ»еӯҗзҡ„жө“еәҰж— е…і В В CпјҺеҸҜзӣҙжҺҘж №жҚ®Kspзҡ„ж•°еҖјеӨ§е°ҸжҜ”иҫғз”өи§ЈиҙЁеңЁж°ҙдёӯзҡ„жә¶и§ЈиғҪеҠӣеӨ§е°Ҹ В В DпјҺеҪ“Kspж”№еҸҳпјҢеҸҜдҪҝжІүж·Җжә¶и§Је№іиЎЎеҸ‘з”ҹ移еҠЁ |
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
25 в„ғж—¶пјҢеңЁpHйғҪзӯүдәҺ9зҡ„NaOHе’ҢCH3COONaдёӨз§Қжә¶ж¶ІдёӯпјҢи®ҫз”ұж°ҙз”өзҰ»дә§з”ҹзҡ„OH- зҰ»еӯҗ В В AmolВ·LпјҚ1дёҺBmolВ·LпјҚ1пјҢеҲҷAе’ҢBе…ізі»дёәпјҲВ В В В пјү В В В AпјҺA>BВ В В В В В В В В В BпјҺ A=10пјҚ4 BВ В В В В В В В В CпјҺB=10пјҚ4 AВ В В В В В В В В В DпјҺA=BВ |
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘжё©еәҰTж—¶ж°ҙзҡ„зҰ»еӯҗз§Ҝеёёж•°дёәKwпјҢиҜҘжё©еәҰдёӢе°Ҷжө“еәҰдёәa molВ·LпјҚ1зҡ„дёҖе…ғй…ёHAдёҺ b molВ·LпјҚ1 В В В зҡ„дёҖе…ғзўұBOHзӯүдҪ“з§Ҝж··еҗҲпјҢеҸҜеҲӨе®ҡиҜҘжә¶ж¶Іе‘ҲдёӯжҖ§зҡ„дҫқжҚ®жҳҜпјҲВ В В В пјү В В AпјҺaпјқbВ В В В В В В В В В В В В В В В В В В В В В В BпјҺж··еҗҲжә¶ж¶ІдёӯпјҢc(HпјӢ)пјқ В В CпјҺж··еҗҲжә¶ж¶Ізҡ„pHпјқ7В В В В В В В В В В В DпјҺж··еҗҲжә¶ж¶ІдёӯпјҢc(HпјӢ)пјӢc(BпјӢ)пјқc(OHпјҚ)пјӢc(AпјҚ) |
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
еҮҶ确移еҸ–20.00 mLжҹҗеҫ…жөӢHClжә¶ж¶ІдәҺй”ҘеҪўз“¶дёӯпјҢз”Ё0.1000 molВ·LпјҚ1 NaOHжә¶ж¶Іж»ҙе®ҡпјҢдёӢеҲ—иҜҙ В В жі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү В В AпјҺж»ҙе®ҡз®Ўз”Ёи’ёйҰҸж°ҙжҙ—ж¶ӨеҗҺпјҢиЈ…е…ҘNaOHжә¶ж¶ІиҝӣиЎҢж»ҙе®ҡ В В BпјҺз”Ёй…ҡй…һдҪңжҢҮзӨәеүӮпјҢеҪ“й”ҘеҪўз“¶дёӯжә¶ж¶Із”ұзәўиүІеҸҳж— иүІж—¶еҒңжӯўж»ҙе®ҡ В В CпјҺз”Ё25 mLй…ёејҸж»ҙе®ҡз®ЎйҮҸеҸ–20.00mLеҫ…жөӢHClжә¶ж¶ІдәҺй”ҘеҪўз“¶дёӯ В В DпјҺж»ҙе®ҡиҫҫз»ҲзӮ№ж—¶пјҢеҸ‘зҺ°ж»ҙе®ҡз®Ўе°–еҳҙйғЁеҲҶжңүжӮ¬ж»ҙпјҢеҲҷжөӢе®ҡз»“жһңеҒҸе°Ҹ |
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёҖе®ҡжқЎд»¶дёӢпјҢNa2CO3жә¶ж¶ІеӯҳеңЁж°ҙи§Је№іиЎЎпјҡCO32пјҚпјӢH2O В дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү В В AпјҺзЁҖйҮҠжә¶ж¶ІпјҢж°ҙи§Је№іиЎЎеёёж•°еўһеӨ§В В В В В В В В В В BпјҺйҖҡе…ҘCO2пјҢе№іиЎЎжңқжӯЈеҸҚеә”ж–№еҗ‘移еҠЁ В В CпјҺеҚҮй«ҳжё©еәҰпјҢ |
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
25 в„ғж—¶пјҢеңЁжө“еәҰеқҮдёә1 molВ·LпјҚ1зҡ„(NH4)2SO4гҖҒ(NH4)2CO3гҖҒ(NH4)2Fe(SO4)2зҡ„жә¶ж¶ІдёӯпјҢжөӢеҫ—е…¶ В В дёӯc(NH В В AпјҺc>a>bВ В В В В В В В В В BпјҺa>b>cВ В В В В В В В В В CпјҺb>a>cВ В В В В В В В В DпјҺa>c>b |
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ25 в„ғж—¶пјҢеҸ–жө“еәҰзӣёеҗҢзҡ„NaOHе’ҢHClжә¶ж¶ІпјҢд»Ҙ3вҲ¶2зҡ„дҪ“з§ҜжҜ”зӣёж··еҗҲпјҢжүҖеҫ—жә¶ж¶Ізҡ„pHзӯү В В дәҺ12пјҢеҲҷеҺҹжә¶ж¶Ізҡ„жө“еәҰдёәпјҲВ В В В пјүВ В В В В В В AпјҺ0.01 molВ·LпјҚ1В В В В В В В В В В В В BпјҺ0.017 molВ·LпјҚ1В В В В В В В В В В В CпјҺ0.50 molВ·LпјҚ1В В В В В В В В В В В DпјҺ0.05 molВ·LпјҚ1 |
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
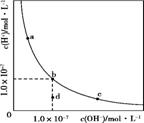
пјҺдёҖе®ҡжё©еәҰдёӢпјҢж°ҙжә¶ж¶ІдёӯH+е’ҢOH-зҡ„жө“еәҰеҸҳеҢ–жӣІзәҝеҰӮеӣҫжүҖзӨәпјҢ В В дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү В В AпјҺеҚҮй«ҳжё©еәҰпјҢеҸҜиғҪеј•иө·з”ұcеҗ‘bзҡ„еҸҳеҢ– В В BпјҺиҜҘжё©еәҰдёӢпјҢж°ҙзҡ„зҰ»еӯҗз§Ҝеёёж•°дёә1.0Г—10пјҚ13 В В CпјҺиҜҘжё©еәҰдёӢпјҢеҠ е…ҘFeCl3еҸҜиғҪеј•иө·з”ұbеҗ‘aзҡ„еҸҳеҢ– В В DпјҺиҜҘжё©еәҰдёӢпјҢзЁҖйҮҠжә¶ж¶ІеҸҜиғҪеј•иө·з”ұcеҗ‘dзҡ„еҸҳеҢ– |
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү
В В BпјҺ25в„ғж—¶пјҢзӯүдҪ“з§Ҝзӯүжө“еәҰзҡ„зЎқй…ёдёҺж°Ёж°ҙж··еҗҲеҗҺпјҢжә¶ж¶ІpH=7 В В CпјҺ25в„ғж—¶пјҢ0.1molВ·LпјҚ1зҡ„зЎ«еҢ–ж°ўжә¶ж¶ІжҜ”зӯүжө“еәҰзҡ„зЎ«еҢ–й’ жә¶ж¶Ізҡ„еҜјз”өиғҪеҠӣејұ В В DпјҺ0.1mol AgClе’Ң0.1molAgIж··еҗҲеҗҺеҠ е…Ҙ1Lж°ҙдёӯпјҢжүҖеҫ—жә¶ж¶Ідёӯc(ClпјҚ)=c(IпјҚ) |
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…із”өи§ЈиҙЁжә¶ж¶Ізҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү В В AпјҺеҗ‘0.1mol В В BпјҺе°ҶCH3COONaжә¶ж¶Ід»Һ20в„ғеҚҮжё©иҮі30в„ғпјҢжә¶ж¶Ідёӯ В В CпјҺеҗ‘зӣҗй…ёдёӯеҠ е…Ҙж°Ёж°ҙиҮідёӯжҖ§пјҢжә¶ж¶Ідёӯ В В DпјҺеҗ‘AgClгҖҒAgBrзҡ„йҘұе’Ңжә¶ж¶ІдёӯеҠ е…Ҙе°‘йҮҸAgNO3пјҢжә¶ж¶Ідёӯ |
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁNa2Sжә¶ж¶ІдёӯдёӢеҲ—е…ізі»дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјүВ В В AпјҺc(Na+) =2c( HSпјҚ) +2c(S2пјҚ) +2c(H2S)В В В В В В В В В В В В В В B.В c(Na+) +c(H+)=c(OH-)+c(HSпјҚ)+ 2c(S2пјҚ) В В CпјҺc(Na+) пјһ c(S2пјҚ) пјһc(OHпјҚ)пјһc(HSпјҚ)В В В В В В В В В В В В DпјҺc(OHпјҚ)=c(HSпјҚ)+c(H+)+ c(H2S) |
|
| 19. | иҜҰз»ҶдҝЎжҒҜ | ||||||||
|
пјҺзӣёеҗҢжё©еәҰдёӢпјҢж №жҚ®дёүз§Қй…ёзҡ„з”өзҰ»еёёж•°пјҢдёӢеҲ—еҲӨж–ӯжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү
В В AпјҺдёүз§Қй…ёзҡ„ејәејұе…ізі»пјҡHXпјһHYпјһHZ В В BпјҺеҸҚеә”HZ+YпјҚ= HY+ZпјҚиғҪеӨҹеҸ‘з”ҹ В В CпјҺзӣёеҗҢжё©еәҰдёӢпјҢ0.1molВ·LпјҚ1зҡ„NaXгҖҒNaYгҖҒNaZжә¶ж¶ІпјҢNaZжә¶ж¶ІpHжңҖеӨ§ В В DпјҺзӣёеҗҢжё©еәҰдёӢпјҢ1molВ·LпјҚ1 HXжә¶ж¶Ізҡ„з”өзҰ»еёёж•°еӨ§дәҺ0.1mol/L HXжә¶ж¶Ізҡ„з”өзҰ»еёёж•° |
|||||||||
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖе®ҡжё©еәҰдёӢпјҢдёӢеҲ—жә¶ж¶Ізҡ„зҰ»еӯҗжө“еәҰе…ізі»ејҸжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү В В AпјҺpH=5зҡ„H2Sжә¶ж¶ІдёӯпјҢcпјҲH+пјү=cпјҲHSпјҚпјү=1Г—10пјҚ5molВ·LпјҚ1 В В BпјҺ pH=aзҡ„ж°Ёж°ҙжә¶ж¶ІпјҢзЁҖйҮҠ10еҖҚеҗҺпјҢе…¶pH=bпјҢеҲҷa=b+1 В В CпјҺpH=2зҡ„д№ҷдәҢй…ёпјҲH2C2O4пјүжә¶ж¶ІдёҺpH=12зҡ„NaOHжә¶ж¶Ід»»ж„ҸжҜ”дҫӢж··еҗҲпјҡ В В cпјҲNa+пјү+cпјҲH+пјү=cпјҲOHпјҚпјү+cпјҲHC2O4пјҚпјү В В DпјҺpHзӣёеҗҢзҡ„в‘ CH3COONaв‘ЎNaHCO3в‘ўNaClOдёүз§Қжә¶ж¶Ізҡ„cпјҲNa+пјүпјҡв‘ >в‘Ў>в‘ў |
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҺHAе’ҢHBдёӨз§Қй…ёзҡ„жә¶ж¶ІеҲҶеҲ«еҠ ж°ҙзЁҖйҮҠж—¶пјҢpHеҸҳеҢ–зҡ„з®ҖеӣҫеҰӮеӣҫжүҖзӨәпјҢдёӢеҲ—еҸҷиҝ°дёӯдёҚжӯЈзЎ® В В зҡ„жҳҜпјҲВ В В В пјү В В AпјҺHAжҳҜдёҖз§Қејәй…ёВ В В В В В В В В В В В В В В В В В BпјҺxзӮ№пјҢc(AпјҚ)пјқc(BпјҚ) В В CпјҺHBжҳҜдёҖз§Қејұй…ёВ В В В В В В В В В В В В В В В В В DпјҺеҺҹжә¶ж¶ІдёӯHAзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёәHBзҡ„10еҖҚ |
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁtв„ғж—¶пјҢAgBrеңЁж°ҙдёӯзҡ„жІүж·Җжә¶и§Је№іиЎЎжӣІзәҝеҰӮдёӢеӣҫжүҖзӨәпјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү
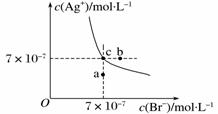
В В BпјҺеңЁAgBrйҘұе’Ңжә¶ж¶ІдёӯеҠ е…ҘNaBrеӣәдҪ“пјҢеҸҜдҪҝжә¶ж¶Із”ұcзӮ№еҸҳеҲ°bзӮ№ В В CпјҺеӣҫдёӯaзӮ№еҜ№еә”зҡ„жҳҜAgBrзҡ„дёҚйҘұе’Ңжә¶ж¶І В В DпјҺеңЁtв„ғж—¶пјҢеҫҖAgBrйҘұе’Ңжә¶ж¶ІеҠ е…ҘKIеӣәдҪ“пјҢдјҡдә§з”ҹй»„иүІжІүж·Җ |
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјү В В AпјҺ0.1 molВ·LпјҚ1 CH3COONaжә¶ж¶Ідёӯпјҡc(NaпјӢ)>c(CH3COOпјҚ)>c(HпјӢ)>c(OHпјҚ) В В BпјҺNa2CO3жә¶ж¶ІеҠ ж°ҙзЁҖйҮҠеҗҺпјҢжҒўеӨҚиҮіеҺҹжё©еәҰпјҢpHе’ҢKwеқҮеҮҸе°Ҹ В В CпјҺеҫҖ0.1molВ·LпјҚ1 Na2SO3жә¶ж¶ІеҠ е…Ҙе°‘йҮҸNaOHеӣәдҪ“пјҢcпјҲSO32вҖ•пјүдёҺcпјҲNaпјӢпјүеқҮеўһеӨ§ В В DпјҺ0.1molВ·LпјҚ1 Na2CO3жә¶ж¶ІзҰ»еӯҗжө“еәҰеӨ§е°Ҹе…ізі»пјҡc(Na+)пјһc(OH-)пјһc(HCO3пјҚ)пјһc(CO32пјҚ)пјһc(H+) |
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
25в„ғж—¶пјҢKsp(BaSO4)=1Г—10пјҚ10пјҢKspВ (BaCO3)=2.6Г—10пјҚ9гҖӮиҜҘжё©еәҰдёӢпјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В В пјүВ В В В гҖҖ CпјҺBaSO4е’ҢBaCO3е…ұеӯҳзҡ„жӮ¬жөҠж¶ІдёӯпјҢ В DпјҺBaSO4жӮ¬жөҠж¶ІдёӯеҠ е…ҘNa2CO3жө“жә¶ж¶ІпјҢBaSO4дёҚеҸҜиғҪиҪ¬еҢ–дёәBaCO3 |
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
ж №жҚ®иҰҒжұӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ В пјҲ1пјүз”ҹжҙ»дёӯжҳҺзҹҫеёёдҪңеҮҖж°ҙеүӮпјҢе…¶еҮҖж°ҙзҡ„еҺҹзҗҶжҳҜВ В В В В В В В В В В В В В В В В В В В В В В пјҲз”ЁзҰ»еӯҗж–№зЁӢејҸиЎЁзӨәпјүгҖӮ В пјҲ2пјүе·ІзҹҘMgOеҸҜжә¶дәҺNH4Clзҡ„ж°ҙжә¶ж¶ІпјҢз”ЁеҢ–еӯҰж–№зЁӢејҸиЎЁзӨәе…¶еҺҹзҗҶВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ В пјҲ3пјүеҺ»е№ҙ8жңҲ12ж—ҘжҷҡпјҢеӨ©жҙҘж»Ёжө·ж–°еҢәеҚұйҷ©е“Ғд»“еә“еҸ‘з”ҹзҲҶзӮёдәӢж•…пјҢе°‘йҮҸж°°еҢ–зү©еӣ зҲҶзӮёеҶІеҮ»еҸ‘з”ҹ В В жі„жјҸпјҢCNдёҖжңүеү§жҜ’пјҢжі„йңІдјҡжұЎжҹ“ж°ҙжәҗе’Ңз©әж°”пјҢйңҖиҰҒеӨ„зҗҶгҖӮ В В В В В В в‘ еҢ…зҹҘHCNдёәдёҖе…ғејұй…ёпјҢеҲҷNaCNжә¶ж¶Ізҡ„pH В В В В В В В В В В В В В 7пјҲеЎ«вҖң>вҖқвҖң=вҖқжҲ–вҖң<вҖқпјүпјҢз”ЁзҰ» В В В В В В еӯҗж–№зЁӢејҸиҜҙжҳҺВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ В В В В В В в‘ЎеӨ„зҗҶеҗ«CNдёҖеәҹж°ҙзҡ„ж–№жі•д№ӢдёҖжҳҜеңЁеҫ®з”ҹзү©зҡ„дҪңз”ЁдёӢпјҢCNпјҚиў«ж°§ж°”ж°§еҢ–жҲҗHCO3дёҖпјҢеҗҢж—¶з”ҹжҲҗ В В В В В В NH3пјҢиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ В пјҲ4пјүеёёжё©дёӢпјҢеҸ–0.2 molВ·LпјҚ1 HClжә¶ж¶ІдёҺ0.2 molВ·LпјҚ1 MOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲпјҢжөӢеҫ—жә¶ж¶Іж··еҗҲеҗҺВ В В В В В В В зҡ„pHпјқ5пјҢеҶҷеҮәMOHзҡ„з”өзҰ»ж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ |
|
| 26. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
з»“еҗҲдёӢиЎЁеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
зҺ°жңүжҹҗй…ёжҖ§CuCl2жә¶ж¶Ідёӯеҗ«жңүе°‘йҮҸзҡ„FeCl2пјҢдёәеҫ—еҲ°зәҜеҮҖзҡ„CuCl2В·2H2Oжҷ¶дҪ“пјҢжҢүеҰӮеӣҫжӯҘйӘӨиҝӣиЎҢжҸҗзәҜпјҡ
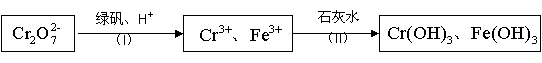
пјҲ1пјүжңҖйҖӮеҗҲдҪңж°§еҢ–еүӮXзҡ„жҳҜ_________(еЎ«еӯ—жҜҚ)пјҢеҠ е…ҘXзҡ„зӣ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮВ В В В В В AпјҺK2Cr2O7В В В В В В В В В В В В BпјҺNaClOВ В В В В В В В В В В В В CпјҺH2O2В В В В В В В В В В В В В DпјҺKMnO4 В В В В еҠ е…Ҙзҡ„зү©иҙЁYжҳҜ____________(еЎ«еҢ–еӯҰејҸ)пјҢи°ғиҮіжә¶ж¶ІpHпјқ4пјҢдҪҝжә¶ж¶Ідёӯзҡ„Fe3пјӢиҪ¬еҢ–дёәFe(OH)3 В В В В В В В жІүж·ҖпјҢжӯӨж—¶жә¶ж¶Ідёӯзҡ„c(Fe3пјӢ)пјқ____________гҖӮиҝҮж»ӨеҗҺпјҢе°ҶжүҖеҫ—ж»Өж¶ІдҪҺжё©и’ёеҸ‘гҖҒжө“зј©з»“жҷ¶пјҢеҸҜ В В В В еҫ—еҲ°CuCl2В·2H2Oжҷ¶дҪ“гҖӮ пјҲ2пјүеңЁз©әж°”дёӯзӣҙжҺҘеҠ зғӯCuCl2В·2H2Oжҷ¶дҪ“еҫ—дёҚеҲ°зәҜзҡ„ж— ж°ҙCuCl2пјҢз”ұCuCl2В·2H2Oжҷ¶дҪ“еҫ—еҲ°зәҜ В В В В зҡ„ж— ж°ҙCuCl2зҡ„еҗҲзҗҶж–№жі•жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ3пјүеҗ«Cr2O
В в‘ з»ҝзҹҫеҢ–еӯҰејҸдёәFeSO4В·7H2OпјҢеҸҚеә”пјҲIпјүзҡ„зҰ»еӯҗж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣВ В В В в‘ЎиӢҘеӨ„зҗҶеҗҺзҡ„еәҹж°ҙдёӯc(Cr3пјӢ)=3.0Г—10пјҚ6 molВ·LпјҚ1пјҢеҲҷеәҹж°ҙдёӯc(Fe3пјӢ)= _________ molВ·LпјҚ1гҖӮ В В В В В пјҲKsp[Fe(OH)3]пјқ4.0Г—10пјҚ38пјҢKsp[Cr(OH) 3]пјқ6.0Г—10пјҚ31пјү |
||||||||||||||||
| 27. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
з…ӨзҮғзғ§жҺ’ж”ҫзҡ„зғҹж°”еҗ«жңүSO2е’ҢNOxпјҢеҪўжҲҗй…ёйӣЁгҖҒжұЎжҹ“еӨ§ж°”пјҢйҮҮз”ЁNaClO2жә¶ж¶ІдҪңдёәеҗё    收еүӮеҸҜеҗҢж—¶еҜ№зғҹж°”иҝӣиЎҢи„ұзЎ«гҖҒи„ұзЎқпјҢеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүеңЁйј“жіЎеҸҚеә”еҷЁдёӯйҖҡе…Ҙеҗ«жңүSO2е’ҢNOзҡ„зғҹж°”пјҢеҸҚеә”жё©еәҰдёә323 KпјҢNaClO2жә¶ж¶Іжө“еәҰдёә В 5Г—10вҲ’3molВ·LвҲ’1гҖӮеҸҚеә”дёҖж®өж—¶й—ҙеҗҺжә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰзҡ„еҲҶжһҗз»“жһңеҰӮдёӢиЎЁгҖӮ
В В в‘ еҶҷеҮәNaClO2жә¶ж¶Іи„ұзЎқиҝҮзЁӢдёӯдё»иҰҒеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ В еўһеҠ еҺӢејәпјҢNOзҡ„иҪ¬еҢ–зҺҮВ В В В В В В В В В В В В пјҲеЎ«вҖңжҸҗй«ҳвҖқгҖҒвҖңдёҚеҸҳвҖқжҲ–вҖңйҷҚдҪҺвҖқпјүгҖӮ В В в‘ЎйҡҸзқҖеҗёж”¶еҸҚеә”зҡ„иҝӣиЎҢпјҢеҗёж”¶еүӮжә¶ж¶Ізҡ„pHйҖҗжёҗВ В В В В В В В В В В В В В пјҲеЎ«вҖңеўһеӨ§вҖқвҖңдёҚеҸҳвҖқжҲ– вҖңеҮҸе°ҸвҖқпјүгҖӮ В В в‘ўз”ұе®һйӘҢз»“жһңеҸҜзҹҘпјҢи„ұзЎ«еҸҚеә”йҖҹзҺҮ______и„ұзЎқеҸҚеә”йҖҹзҺҮпјҲеЎ«вҖңеӨ§дәҺвҖқжҲ–вҖңе°ҸдәҺвҖқпјүгҖӮеҺҹеӣ жҳҜйҷӨдәҶSO2 В В В В В В е’ҢNOеңЁзғҹж°”дёӯзҡ„еҲқе§Ӣжө“еәҰдёҚеҗҢпјҢиҝҳеҸҜиғҪжҳҜВ В В В В В В В В В В В В В В гҖӮ В пјҲ2пјүеңЁдёҚеҗҢжё©еәҰдёӢпјҢNaClO2жә¶ж¶Іи„ұзЎ«гҖҒи„ұзЎқзҡ„еҸҚеә”дёӯпјҢSO2е’ҢNO зҡ„е№іиЎЎеҲҶеҺӢpcеҰӮеӣҫжүҖзӨәгҖӮз”ұеӣҫеҲҶжһҗеҸҜзҹҘпјҢеҸҚеә”жё©еәҰеҚҮй«ҳпјҢи„ұзЎ«гҖҒ и„ұзЎқеҸҚеә”зҡ„е№іиЎЎеёёж•°еқҮ_________пјҲеЎ«вҖңеўһеӨ§вҖқгҖҒвҖңдёҚеҸҳвҖқжҲ–вҖңеҮҸе°ҸвҖқпјүгҖӮ |
|||||||||||||
| 28. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүpHеқҮдёә2зҡ„зӣҗй…ёгҖҒзЎ«й…ёгҖҒйҶӢй…ёдёү瓶жә¶ж¶І В В В В В В В В пјңгҖҒ=вҖқиЎЁзӨәпјҢдёӢеҗҢпјүгҖӮ В В В В В В В В жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ В В В В В В В В V2гҖҒV3пјҢеҲҷе…¶е…ізі»жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ В В В В В В В В еҲҷе…¶е…ізі»жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ |
|
| 29. | иҜҰз»ҶдҝЎжҒҜ |
|
ејұз”өи§ЈиҙЁзҡ„з”өзҰ»е№іиЎЎгҖҒзӣҗзұ»зҡ„ж°ҙи§Је№іиЎЎе’Ңйҡҫжә¶зү©зҡ„жә¶и§Је№іиЎЎеқҮеұһдәҺеҢ–еӯҰе№іиЎЎпјҢж №жҚ®иҰҒ В В В жұӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ В В пјҲ1пјүеҗ‘ ZnSO4жә¶ж¶Ідёӯж»ҙеҠ йҘұе’ҢH2Sжә¶ж¶ІпјҢжІЎжңүжІүж·Җз”ҹжҲҗпјҢ继з»ӯж»ҙеҠ дёҖе®ҡйҮҸзҡ„ж°Ёж°ҙеҗҺпјҢз”ҹжҲҗZnSжІүж·ҖпјҢз”Ёз”өзҰ»е№іиЎЎеҺҹзҗҶи§ЈйҮҠдёҠиҝ°зҺ°иұЎ _______________________________________________ гҖӮ В В пјҲ2пјүAlCl3жә¶ж¶Іи’ёе№Іе№¶зҒјзғ§еҫ—еҲ°зҡ„зү©иҙЁжҳҜ__________ пјҲеЎ«еҢ–еӯҰејҸпјүгҖӮ В В пјҲ3пјү0.1 molВ·LпјҚ1зҡ„(NH4)2SO4жә¶ж¶ІпјҢеңЁиҜҘжә¶ж¶Ідёӯеҗ„з§ҚзҰ»еӯҗзҡ„жө“еәҰз”ұеӨ§еҲ°е°ҸйЎәеәҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ В В пјҲ4пјү0.1molВ·LпјҚ1зҡ„NaHAжә¶ж¶ІдёӯпјҢзІ’еӯҗжө“еәҰз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёәпјҡ В В В В cпјҲNa+пјү>cпјҲHAвҖ”пјү>cпјҲH2Aпјү>cпјҲA2пјҚпјү В В в‘ иҜҘжә¶ж¶ІдёӯжҳҫВ В В В В В В пјҲеЎ«вҖңй…ёжҖ§вҖқгҖҒвҖңзўұжҖ§вҖқжҲ–вҖңдёӯжҖ§вҖқпјүпјӣ В В в‘ЎдҪңеҮәдёҠиҝ°еҲӨж–ӯзҡ„дҫқжҚ®жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲз”Ёж–Үеӯ—и§ЈйҮҠпјүгҖӮ |
|
| 30. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||
|
еёёжё©дёӢпјҢе°ҶжҹҗдёҖе…ғй…ёHAе’ҢNaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲпјҢдёӨз§Қжә¶ж¶Ізҡ„жө“еәҰе’Ңж··еҗҲеҗҺжүҖеҫ—жә¶ В В В ж¶Ізҡ„pHеҰӮдёӢиЎЁпјҡ
В В В В иҜ·ж №жҚ®иҰҒжұӮеӣһзӯ”пјҡ пјҲ1пјүв‘Ўз»„жғ…еҶөиЎЁжҳҺпјҢc________ (йҖүеЎ«вҖңеӨ§дәҺвҖқгҖҒвҖңе°ҸдәҺвҖқжҲ–вҖңзӯүдәҺвҖқ)0.2гҖӮж··еҗҲж¶ІдёӯзҰ»еӯҗжө“еәҰc(AпјҚ) В В В В дёҺc(NaпјӢ)зҡ„еӨ§е°Ҹе…ізі»жҳҜ________В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүд»Һв‘ўз»„е®һйӘҢз»“жһңеҲҶжһҗпјҢиҜҙжҳҺHAзҡ„з”өзҰ»зЁӢеәҰ________(йҖүеЎ«вҖңеӨ§дәҺвҖқгҖҒвҖңе°ҸдәҺвҖқжҲ–вҖңзӯүдәҺвҖқ)NaA В В В В зҡ„ж°ҙи§ЈзЁӢеәҰпјҢиҜҘж··еҗҲжә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ В В В пјҲ3пјүв‘ з»„е®һйӘҢжүҖеҫ—ж··еҗҲжә¶ж¶Ідёӯз”ұж°ҙз”өзҰ»еҮәзҡ„c(OHпјҚ)пјқ____________molВ·LпјҚ1гҖӮ В В В В В В В В еҶҷеҮәиҜҘж··еҗҲжә¶ж¶ІдёӯдёӢеҲ—з®—ејҸзҡ„з»“жһң(дёҚиғҪдҪңиҝ‘дјји®Ўз®—)гҖӮ В В В В В В В c(NaпјӢ)пјҚc(AпјҚ)пјқ________molВ·LпјҚ1пјӣВ В В В В c(OHпјҚ)пјҚc(HA)пјқ________molВ·LпјҚ1гҖӮ |
|||||||||||||||||
| 31. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||
|
жҹҗеӯҰз”ҹз”Ё0.2000molВ·LпјҚ1зҡ„ж ҮеҮҶNaOHжә¶ж¶Іж»ҙе®ҡжңӘзҹҘжө“еәҰзҡ„зӣҗй…ёпјҢе…¶ж“ҚдҪңеҰӮдёӢпјҡ В В В В еӨ§вҖқгҖҒвҖңеҒҸе°ҸвҖқжҲ–вҖңж— еҪұе“ҚвҖқ)гҖӮ В В В В з•ҷжңүе°‘йҮҸи’ёйҰҸж°ҙпјҢжөӢе®ҡз»“жһң____________пјҲеЎ«вҖңеӨ§вҖқгҖҒвҖңеҒҸе°ҸвҖқжҲ–вҖңж— еҪұе“ҚвҖқпјүгҖӮ В В В В В еҲӨж–ӯеҲ°иҫҫж»ҙе®ҡз»ҲзӮ№зҡ„дҫқжҚ®жҳҜ_______________________________________________________гҖӮ пјҲ4пјүд»ҘдёӢжҳҜе®һйӘҢж•°жҚ®и®°еҪ•иЎЁ
В В В В В В д»ҺдёҠиЎЁеҸҜд»ҘзңӢеҮәпјҢ第1ж¬Ўж»ҙе®ҡи®°еҪ•зҡ„NaOHжә¶ж¶ІдҪ“з§ҜжҳҺжҳҫеӨҡдәҺеҗҺдёӨж¬Ўзҡ„дҪ“з§ҜпјҢе…¶еҸҜиғҪзҡ„еҺҹеӣ В В В В В жҳҜпјҲгҖҖВ В пјү
В В В В В зҡ„зӣҗй…ёе’ҢйҶӢй…ёпјҢж»ҙе®ҡжӣІзәҝеҰӮеӣҫжүҖзӨәпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү В AпјҺв…ЎиЎЁзӨәзҡ„жҳҜж»ҙе®ҡйҶӢй…ёзҡ„жӣІзәҝ В BпјҺpH=7ж—¶пјҢж»ҙе®ҡйҶӢй…ёж¶ҲиҖ—V(NaOH)е°ҸдәҺ20ml В CпјҺV(NaOH) =20mlж—¶пјҢC( ClпјҚ )== C(CH3COOпјҚ ) В DпјҺV(NaOH) =10mlж—¶пјҢйҶӢй…ёжә¶ж¶ІдёӯпјҡC( Na+ )пјһ C(CH3COOпјҚ)пјһ C( H+ )пјһ C(OHпјҚ) |
|||||||||||||||||||
- йҷ•иҘҝ2019е№ҙй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҲиҖғжөӢйӘҢеңЁзәҝзӯ”йўҳ
- дёҠжө·й«ҳдәҢеҢ–еӯҰ2018е№ҙдёӢеҚҠжңҹжңҹдёӯиҖғиҜ•еңЁзәҝеҒҡйўҳ
- й«ҳдәҢдёӢеҚҠе№ҙжңҹдёӯиҖғиҜ•еҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲ2018-2019е№ҙйҮҚеәҶеёӮ第八дёӯеӯҰпјү
- 2019-2020е№ҙй«ҳдёҖеҗҺеҚҠжңҹжңҹдёӯж®өиҖғеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲе№ҝиҘҝеҚ—е®ҒеёӮ第дёүдёӯеӯҰпјү
- 2019еұҠй«ҳдёүдёӢеҶҢ第дёҖж¬ЎжЁЎжӢҹиҖғиҜ•зҗҶз»јеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲеұұдёңжі°е®үиӮҘеҹҺеёӮпјү
- 2019-2020е№ҙй«ҳдәҢдёҠеҶҢжңҹдёӯиҖғиҜ•еҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲжөҷжұҹзңҒжөҷдёңеҢ—иҒ”зӣҹпјү
- з»өйҳіеёӮй«ҳдәҢеҢ–еӯҰжңҹдёӯиҖғиҜ•пјҲ2019е№ҙдёӢеҶҢпјүе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- еӣӣе·қ2019е№ҙй«ҳдёүдёӢеҚҠжңҹеҢ–еӯҰжңҲиҖғжөӢйӘҢеҗҢжӯҘз»ғд№