2018安徽高二下学期人教版高中化学开学考试
| 1. | 详细信息 |
|
将0.15mol的MnO2与过量的12mol/L的浓盐酸反应,与50mL12mol/L的浓盐酸与过量MnO2反应,两者产生的氯气相比(其它反应条件相同)( )
|
|
| 2. | 详细信息 |
|
下列措施中,一定能使化学平衡移动的是( ) A.改变温度 B.改变压强 C.使用催化剂 D.改变容器体积
|
|
| 3. | 详细信息 |
|
对于100mL 1mol/L盐酸与铁片的反应,采取下列措施能使反应速率加快的是( )
|
|
| 4. | 详细信息 |
|
已知H+(aq)+OH﹣(aq)=H2O(l);△H=﹣57.3kJ/mol.若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:
|
|
| 5. | 详细信息 |
|
宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2=2Ag2S+2H2O,其中H2S是( )
|
|
| 6. | 详细信息 |
|
下列说法正确的是( )
|
|
| 7. | 详细信息 |
|
N2+3H2⇌2NH3在密闭容器中反应一段时间后,达到限度.则下列说法正确的是( )
|
|
| 8. | 详细信息 |
|
下列化学反应属于吸热反应的是( )
|
|
| 9. | 详细信息 |
|
下列化工生产原理错误的是( )
|
|
| 10. | 详细信息 |
|
2A(g)+B(g)⇌3C(g)+4D(g)的反应,在不同条
|
|
| 11. | 详细信息 |
|
有等体积、等pH的Ca(OH)2、KOH和NH3•H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3 , 则三者的大小关系正确的是( )
|
|
| 12. | 详细信息 |
|
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生NO2(g)+SO2(g)⇌SO3(g)+NO(g)的可逆反应,下列能说明反应达到平衡状态的是( )
|
|
| 13. | 详细信息 |
|
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的.由X、Y和Z三种元素形成的一种盐溶于水后,加入
|
|
| 14. | 详细信息 |
|
向27.2gCu和Cu2O(物质的量之比为2:1)的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2 。在所得溶液中加入1.0 mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子恰好完全沉淀。下列有关说法错误的是 A.混合物中Cu的物质的量为0.2 mol B.产生的NO在标准状况下的体积为4.48L C.原硝酸的物质的量浓度为2.6mol/L D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
|
|
| 15. | 详细信息 |
|
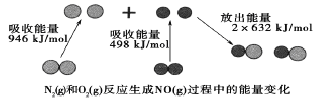
化学反应中的能量变化是由化学反应中旧化学健断裂时吸收的能量与化学健形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是
A. 1molN2(g)和1molO2(g)反应放出的能量为180kJ B. 1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量 C. 在1L的容器中发生反应.10min内N2减少了1mol,因此10min内的平均反应速率为v(NO)=0.1mol/(L·min) D. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
|
|
| 16. | 详细信息 |
|
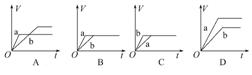
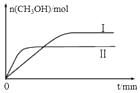
将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是
|
|
| 17. | 详细信息 |
|
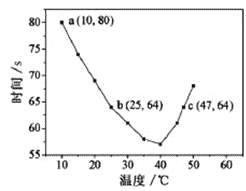
.NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol/LNaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时
A. 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 B. 图中b、c两点对应的NaHSO3反应速率相等 C. 图中a点对应的NaHSO3反应速率为5.0×10-5mol·L-1·s-1 D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
|
|
| 18. | 详细信息 |
|
NA表示阿伏加德罗常数数值,下列有关说法正确的是 A. 18.4 mol/L的浓硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA C. 50 mL 14.0 mol·L-1浓硝酸与足量铜反应,转移的电子数为0.35 NA D. 同温同压同体积下的两种气体12C18O和14N2具有的电子数相等
|
|
| 19. | 详细信息 | ||||||||||||||||||||
|
下物质分类组合正确的是 ( )
A. A B. B C. C D. D
|
|||||||||||||||||||||
| 20. | 详细信息 |
|
已知1 g氢气完全燃烧生成水蒸气时,放出热量121 kJ。且氢气中1 mol H-H键断裂时吸收热量为436kJ,水蒸气中1 mol H-O键形成时放出热量463kJ,则氧气中1 mol O=O键完全断裂时吸收热量为( ) A. 49
|
|
| 21. | 详细信息 |
|
在一定条件下,反应N2 + 3H2 A. 1.2mol·L-1·min-1 B. 1.0mol·L-1·min-1 C. 0.6mol·L-1·min-1
|
|
| 22. | 详细信息 |
|
氙和氟单质按一定比例混合,在一定条件下反应达到如下平衡:Xe(气)+2F2(气)⇌ XeF4(气) △H=-218kJ/mol,下列措施中既能加快反应速率,又能使平衡向正反应方向移动的是 A. 加压 B. 减压 C. 升温 D. 降温
|
|
| 23. | 详细信息 |
|
下列说法中正确的是 A.焓变是指1 mol物质参加反应时的能量变化 B.反应放热时,ΔH>0;反应吸热时,ΔH<0 C.在一个确定的化学反应关系中,反应物的总焓与生成物的总焓一定不同 D.在一个确定的化学反应关系中,反应物的总焓总是高于生成物的总焓
|
|
| 24. | 详细信息 |
|
某温度下,恒压装置中N2(g)+3H2(g)
A. 平衡状态由A变到B时,平衡常数K(A)<K(B) B. 上述反应在达到平衡后,充入He气,H2的转化率减小 C. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 D. 将1mol氮气、3mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
|
|
| 25. | 详细信息 |
|
下列电解质溶液中有关浓度关系不正确的是( ) A. 浓度均为0.1 mol/L的HF、KF混合溶液中:2c(H+)+c(HF)=2c(OH-)+c(F-) B. 铵根离子浓度均为0.1 mol/L的 ①NH4Cl、②NH4Al(SO4)2、③NH4HCO3三种溶液的浓度:③>①>② C. 常温下,pH=5的NaHSO3溶液中,水电离出的c(H+)=1.0×10-9 mol/L D. 0.1 mol/L的Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
|
|
| 26. | 详细信息 |
|
利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
|
|
| 27. | 详细信息 | ||||||||||
|
现有下列物质:
|
|||||||||||
| 28. | 详细信息 | ||||||||||||
|
甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
则x= 。
|
|||||||||||||
| 29. | 详细信息 |
|
近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题: (1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是_____(填标号)。 A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 B.氢硫酸的热稳定性强于亚硫酸 C.同浓度的氢硫酸和亚硫酸的pH为前者大于后者 D.氢硫酸的还原性强于亚硫酸 (2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
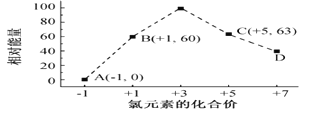
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________、___________,制得等量H2所需能量较少的是_______。 (3)一定条件,在水溶液中1 mol Cl-、ClO x-(x=1,2,3,4)的能量(KJ)相对大小如图所示。
①D是______________________ (填离子符号)。 ②B→A+C反应的热化学方程式为______________________ (用离子符号表示)。
|
|
| 30. | 详细信息 |
|
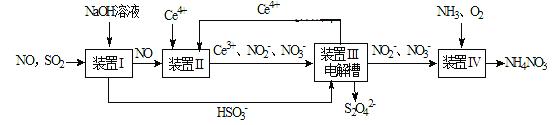
连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,工业上可通过吸收大气污染物(含有SO2、NO等制取),同时还可得到NH4NO3产品,工艺流程图如下(Ce为铈元素):
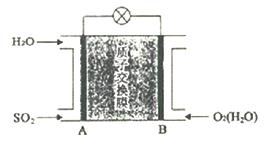
请回答下列问题: (1)装置I中可生成NaHSO3。常温下NaHSO3溶液呈酸性的原因是____________。 (2)装置II中酸性条件下,NO被Ce4+氧化为NO3- 时,氧化产物与还原产物的物质的量之比为______。 (3)装置III中阴极上的电极反应式为__________。若装置IV中NO2- 的浓度为11.5g·L-1要使1dm3该 溶液中的NO2- 完全转化为NH4NO3,至少向装置IV中通入标准状况下的O2__________L。 (4)Na2S2O4在空 ①2Na2S2O4+O2+2H2O=4NaHSO3; ②Na2S2O4+O2+H2O=NaHSO3+ NaHSO4。 请设计实验证明氧化时一定有反应②发生______________。 (5)SO2—空气质子交换膜燃料电池原理示意图如下图:
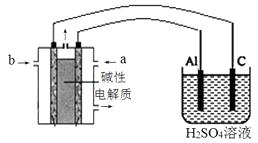
质子的流动方向为__________(“从A到B”或“从B到A”),负极的电极反应式为_____________。
|
|