2017高二下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
下列物质分类正确的是( ) A.Na2O2、CaO、Na2O都是碱性氧化物 B.稀豆浆、硅酸、氯化铁溶液都属于胶体 C.烧碱、醋酸、酒精都属于电解质 D.福尔马林、盐酸、氨水均为混合物
|
|
| 2. | 详细信息 |
|
分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是 ( ) A.冰醋酸、纯碱、石灰石分别属于酸、碱、盐 B.HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 C.漂白粉、冰水、氯水均为混合物 D. Na2O,NaOH,Na2CO3,NaCl,都属于钠的氧化物
|
|
| 3. | 详细信息 |
|
下列与含氯化合物有关的说法正确的是( ) A.HClO是弱酸,所以NaClO是弱电解质 B.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 C.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 D.电解H2O溶液得到22.4L H2(标准状况),理论上需要转移NA个电子
|
|
| 4. | 详细信息 |
|
用NA表示阿伏加德罗常数,下列说法正确的是( ) A.1mol OH﹣中含有9NA个电子 B.28g的CO气体中含有NA个氧原子 C.1L 1mol/L的AlCl3溶液中含有NA个Al3+ D.常温常压下11.2 L的甲烷气体含有的分子数为0.5NA
|
|
| 5. | 详细信息 |
|
设NA为阿伏伽德罗常数的值,下列说法正确的是( ) A.在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA B.100ml 1mol/L的FeCl3溶液中Fe3+数目为0.1NA C.标准状况下,22.4L的CCl4中含有的CCl4分子数为NA来 D.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
|
|
| 6. | 详细信息 |
|
用NA表示阿德罗常数 A.标准状况下,5.6LO2与5.6LNO混合后的分子总数为0.5AN B.标准状况下,22.4L C6H6分子中含有6NA个C-C单键 C.7.8克过氧化钠中含0.2NA阳离子和0.1NA阴离子 D.在500ml0.1mol·L-1NaAlO2溶液中AlO2-数为0.05NA
|
|
| 7. | 详细信息 |
|
下列反应的离子方程式正确的是 ( ) A.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ B.钠与CuSO4溶液反应:2Na+Cu2+= Cu↓+2Na+ C.AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O = AlO2- +4NH4+ +2H2O D.用双氧水和稀硫酸处理印刷电路板:Cu + H2O2 + 2H+ = Cu2+ + 2H2O
|
|
| 8. | 详细信息 |
|
能正确表示下列反应的离子方程式是( ) A.NaNO2溶液中加入酸性KMnO4溶液:2MnO4﹣+5NO2﹣+6H+═2Mn2++5NO3﹣+3H2O B.碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3﹣+2OH﹣═CO32﹣+NH3•H2O+H2O C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I﹣═2Fe2++I2 D.用惰性电极电解熔融氯化钠:2Cl﹣+2H2O═Cl2↑+H2↑+2OH﹣
|
|
| 9. | 详细信息 |
|
下列离子方程式书写正确的是( ) A.碳酸钠溶液中逐滴加入与之等物质的量的盐酸:CO32-+2H+=CO2↑+H2O B.向碳酸氢钡溶液中加入少许氢氧化钠: Ba2++HCO3-+OH-=BaCO3↓+H2O C.向次氯酸钙溶液中通入过量的二氧 D. 向复盐 (NH4)2Fe(SO4)2溶液中加少许Ba(OH) 2: SO42-+2NH4++Ba2++2OH-=BaSO4↓+2NH3•H2O
|
|
| 10. | 详细信息 |
|
某无色溶液中能大量共存的一组离子是( ) A. OH﹣、Ba2+、HCO3﹣、Cl﹣ B. K+、Fe2+、H+、NO3﹣ C.NH4+、Al3+、Cl﹣、NO3﹣ D. Mg2+、SO42﹣、SiO32﹣、H+
|
|
| 11. | 详细信息 |
|
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( ) A.无色溶液中: Al3+、Cl—、MnO4—、SO42— B.含有大量Fe3+的溶液中:Na+、Mg2+、NO3—、SCN— C. 0.1 mol·L-1AgNO3溶液:H+、K+、SO42—、I— D.使酚酞变红色的溶液:CO32—、Cl—、F—、K+
|
|
| 12. | 详细信息 |
|
常温下,下列各组离子在指定溶液中能大量共存的是( ) A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ B.由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- D. c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、HCO3-
|
|
| 13. | 详细信息 |
|
在酸性高锰酸钾溶液中加入过氧化钠粉末发生反应的离子方程式为: 2MnO4-+16H++5Na2O2═2Mn2++5O2↑+8H2O+10Na+.下列判断正确的是( ) A.O2是还原产物,Mn2+是氧化产物 B.Na2O2既是氧化剂,又是还原剂 C.标准状况下,产生22.4L O2时反应转移2mol e﹣ D.通常用浓盐酸酸化高锰酸钾溶液
|
|
| 14. | 详细信息 |
|
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是( ) A.2Fe2++I2 = 2Fe3++2I- B.I2+SO2+2H2O = H2SO4+2HI C. 2Fe3++SO2+2H2O = 2Fe2++SO42- +4H+ D.H2O2+SO2 = H2SO4
|
|
| 15. | 详细信息 |
|
N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O: 3CO+2NO2 =3CO2 +N2O。下列关于N2O的说法一定正确的是( ) A.上述反应,每生成lmolN2O,消耗67.2LCO B.等物质的量的NO和CO含有相等的电子数 C.N2O只有氧化性,无还原性 D.CO会迅速与人体血红蛋白结合,使人中毒
|
|
| 16. | 详细信息 |
|
当光束通过下列分散系:①有尘埃的空气②氯化铁稀溶液③稀豆浆④墨水; |
|
| 17. | 详细信息 |
|
下列化合物中,只有在水溶液中才能导电的电解质是( ) |
|
| 18. | 详细信息 |
|
下列水溶液中的电离方程式书写不正确的是( ) |
|
| 19. | 详细信息 |
|
下列物质中既能与盐酸反应,又能与NaOH溶液反应的是( )
|
|
| 20. | 详细信息 |
|
下列说法中不正确的是( ) A. Na2CO3比NaHCO3易溶于水 B. Na2CO3比NaHCO3稳定 C. 石灰水能与Na2CO3反应,而不能与NaHCO3反应 D. 与足量盐酸反应得到相同质量的CO2,所用NaHCO3的质量比Na2CO3的质量要少
|
|
| 21. | 详细信息 |
|
(1)NA表示阿伏加德罗常数的数值。46g NO2和N2O4的混合气体中含有____NA个氧原子;2L 0.6 mol/L Fe(NO3)3溶液中含_____NA个NO3-离子。 (2)三氟化氮(NF3)是一种气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3, ① 写出该反应的化学方程式 。 ② 三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测 NF3,F2,NO三种气体中,氧化性由强到弱的顺序为 (3)H2C2O4溶液和KMnO4酸性溶液可发生反应: H2C2O4+ MnO4-+ H+→ CO2+ Mn2++ H2O,反应中每生成标况下4.48L CO2气体,外电路中通过的电子的物质的量为__________mol。 (4)制备联氨(N2H4)时,将次氯酸钠与氨气反应,写出该反应的化学方程式
|
|
| 22. | 详细信息 |
|
高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂. (1)Na2FeO4中铁元素的化合价是 价,Na2FeO4具有较强的 (填“氧化性”或“还原性”). (2)工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:完成下列化学方程式: 2FeCl3 + 10NaOH + 3NaClO = 2 + 5 + 9 。 (3)实验室配制500mL 16mol/L NaOH溶液,需NaOH g,配制过程所需玻璃仪器是 、 、 、 。若在定容时俯视液面,会导致溶液浓度 。(填“偏低”或“偏高”或“不变”) (4)将氢气通入10 g灼热的氧化铜中,过一段时间后得到8.4 g固体,下列说法正确的是 ( ) A.有8.4 g铜生成 B.有8 g氧化铜参加反应 C.有1.6 g水生成 D.有10 g氧化铜被还原 (5)某试剂厂生产的化学试剂Fe2(SO4)3,国家规定其二级品含量不低于99.0%.,三级品不低于96.0%.。现称取0500.g样品将其溶于水,向所得溶液中加入少量盐酸使之酸化,并加入适量KI溶液充分反应,最后用0.100 mol/L Na2S2O3标准溶液滴定,反应如下: I2+2Na2S2O3=2NaI+Na2S4O6,滴定达终点时用去Na2S2O312.25mL试通过计算说明此样品属于哪一级产品?请写出过程,然后计算得数。
|
|
| 23. | 详细信息 |
|
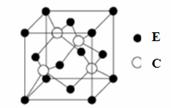
A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。回答下列问题: (1)D原子的核外电子排布式为 ,E的价层电子轨道示图为____________。 (2)B的同主族氢化物中,其中沸点高的是 (填分子式),原因是 ; 该分子是 分子。(填“极性”或“非极性”)
(4)E与C所形成化合物晶体的晶胞如右图所示。 ①在1个晶胞中,E离子的数目为 。 ②该化合物的化学式为 。若用 g/cm3。
|
|