2018еӣӣе·қй«ҳдёҖдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
жҲ‘еӣҪйҰ–йғЁгҖҠйЈҹе“Ғе®үе…Ёжі•гҖӢдәҺ2009е№ҙ6жңҲ1ж—ҘйўҒеёғж–ҪиЎҢпјҢдёӢеҲ—иғҪдҝқиҜҒйЈҹе“Ғе®үе…Ёзҡ„жҳҜ AпјҺз”ІйҶӣжөёжіЎжө·дә§е“ҒВ В В В В В В В В В В В BпјҺе·Ҙдёҡй…’зІҫеӢҫе…‘йҘ®з”Ёй…’ CпјҺз”Ёж°ўж°§еҢ–й“қжІ»з–—иғғй…ёиҝҮеӨҡВ В В В DпјҺз”Ёе·ҘдёҡзҹіиңЎз»ҷиӢ№жһңжү“иңЎзҫҺе®№
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢжңүдёүз»„ж··еҗҲзү©пјҡв‘ ж°ҜеҢ–й’ е’Ңж°ҙпјӣв‘ЎзЎ«й…ёй’Ўе’Ңж°ҙпјӣв‘ўз…ӨжІ№е’Ңж°ҙгҖӮеҲҶзҰ»д»ҘдёҠж··еҗҲж¶Ізҡ„жӯЈзЎ®ж–№жі•дҫқж¬ЎжҳҜВ В В AпјҺеҲҶж¶ІгҖҒиҗғеҸ–гҖҒи’ёйҰҸВ В В В В В В В В В В В В В BпјҺи’ёеҸ‘гҖҒиҝҮж»ӨгҖҒеҲҶж¶ІВ CпјҺеҲҶж¶ІгҖҒи’ёеҸ‘гҖҒиҗғеҸ–В В В В В В В В В В В В В В DпјҺи’ёйҰҸгҖҒиҗғеҸ–гҖҒеҲҶж¶І
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
дёӢиЎЁдёәеҗ„зү©иҙЁдёӯжүҖеҗ«зҡ„жқӮиҙЁд»ҘеҸҠйҷӨеҺ»иҝҷдәӣжқӮиҙЁйҖүз”Ёзҡ„иҜ•еүӮжҲ–ж“ҚдҪңж–№жі•пјҢжӯЈзЎ®зҡ„жҳҜ
|
|||||||||||||||||||||
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ AпјҺеҚ•иҙЁй“қеңЁз©әж°”дёӯжҜ”иҫғиҖҗи…җиҡҖпјҢжүҖд»Ҙй“қжҳҜдёҚжҙ»жіјйҮ‘еұһ BпјҺй“ҒдёҺж°ҙи’ёж°”еңЁй«ҳжё©дёӢзҡ„еҸҚеә”дә§зү©дёәFe2O3е’ҢH2 CпјҺй“қеҲ¶йӨҗе…·дёҚе®ңй•ҝж—¶й—ҙзӣӣж”ҫжҳҫй…ёжҖ§гҖҒзўұжҖ§жҲ–е’ёзҡ„йЈҹзү© DпјҺй’ еңЁдёҚеҗҢжқЎд»¶дёӢдёҺж°§ж°”зҡ„еҸҚеә”пјҢдә§зү©зӣёеҗҢ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—е…ідәҺй’ зҡ„еҸҷиҝ°пјҢжӯЈзЎ®зҡ„жҳҜ в‘ й’ дёҺж°ҙеҸҚеә”ж—¶жө®дәҺж°ҙйқўдё”е‘Ҳе°ҸзҗғзҠ¶жёёеҠЁгҖҖВ В В В в‘Ўй’ еҸҜд»ҘдҝқеӯҳеңЁз…ӨжІ№дёӯгҖҖ в‘ўй’ е…ғзҙ еңЁиҮӘ然з•ҢдёӯеҸӘиғҪд»ҘеҢ–еҗҲжҖҒеҪўејҸеӯҳеңЁгҖҖВ В В в‘Јй’ еҸҜд»ҺзЎ«й…ёй“ңжә¶ж¶ІдёӯзҪ®жҚўеҮәй“ңгҖҖ в‘ӨйҮ‘еұһй’ ж—ўжңүиҝҳеҺҹжҖ§еҸҲжңүж°§еҢ–жҖ§ AпјҺв‘ в‘Ўв‘ўгҖҖВ В В BпјҺв‘ўв‘Јв‘ӨгҖҖВ В CпјҺв‘Ўв‘ўв‘ӨгҖҖВ В DпјҺв‘ в‘ўв‘Ө
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еә”з”ЁжҲ–дәӢе®һдёҺиғ¶дҪ“зҡ„жҖ§иҙЁжІЎжңүе…ізі»зҡ„жҳҜВ В В В AпјҺз”ЁжҳҺзҹҫеҮҖеҢ–йҘ®з”Ёж°ҙ В В В BпјҺз”өжіійҷӨе°ҳ В В В CпјҺеңЁFeCl3жә¶ж¶Ідёӯж»ҙеҠ NaOHжә¶ж¶ІеҮәзҺ°зәўиӨҗиүІжІүж·Җ DпјҺжё…жҷЁзҡ„йҳіе…үз©ҝиҝҮиҢӮеҜҶзҡ„жһ—жңЁжһқеҸ¶жүҖдә§з”ҹзҡ„зҫҺдёҪжҷҜиұЎпјҲзҫҺдёҪзҡ„е…үзәҝпјү
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҚиғҪз”ЁжқҘйүҙеҲ«Na2CO3е’ҢNaHCO3дёӨз§ҚзҷҪиүІеӣәдҪ“зҡ„е®һйӘҢж“ҚдҪңжҳҜ В В В A. еҲҶеҲ«еҠ зғӯиҝҷдёӨз§ҚеӣәдҪ“зү©иҙЁпјҢ并е°Ҷз”ҹжҲҗзҡ„ж°”дҪ“йҖҡе…Ҙжҫ„жё…зҡ„зҹізҒ°ж°ҙдёӯ В В В B. еҲҶеҲ«еңЁиҝҷдёӨз§Қзү©иҙЁзҡ„жә¶ж¶ІдёӯеҠ е…ҘCaCl2жә¶ж¶І C. еҲҶеҲ«еңЁиҝҷдёӨз§Қзү©иҙЁзҡ„жә¶ж¶ІдёӯеҠ е…Ҙе°‘йҮҸжҫ„жё…зҡ„зҹізҒ°ж°ҙ D. еҲҶеҲ«еңЁиҝҷдёӨз§ҚеӣәдҪ“дёӯеҠ е…ҘеҗҢжө“еәҰзҡ„зЁҖзӣҗй…ё
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—й…ҚеҲ¶0.5 mol/Lзҡ„NaOHжә¶ж¶Ізҡ„ж“ҚдҪңдёҚдјҡйҖ жҲҗиҜҜе·®зҡ„жҳҜ AпјҺз§°йҮҸеҗҺиҪ¬з§»еӣәдҪ“ж—¶дёҚе°ҸеҝғжҠҠе°‘йҮҸеӣәдҪ“жҙ’еҲ°зғ§жқҜеӨ– BпјҺе®№йҮҸ瓶жңӘе№ІзҮҘпјҢжңүе°‘йҮҸи’ёйҰҸж°ҙ, CпјҺжңӘз»ҸеҶ·еҚҙе°ұиҪ¬з§»е®ҡе®№пјҢдёҠдёӢеҸҚеӨҚйў еҖ’ж‘ҮеҢҖ DпјҺе®ҡе®№ж—¶пјҢеҠ ж°ҙи¶…иҝҮеҲ»еәҰзәҝпјҢеҖ’еҮәеҗҺ并жҒўеӨҚеҲ°еҲ»еәҰзәҝж°ҙе№і
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢж–№жЎҲи®ҫи®ЎеҸҜиЎҢзҡ„жҳҜ AпјҺз”ЁжҙҒеҮҖзҡ„й“ӮдёқиҳёеҸ–KClжә¶ж¶ІпјҢеңЁй…’зІҫзҒҜзҒ«з„°дёҠзҮғзғ§пјҢи§ӮеҜҹй’ҫзҡ„з„°иүІ BпјҺйҖҡиҝҮеҸҜжә¶жҖ§й“қзӣҗжә¶ж¶ІдёҺиҝҮйҮҸж°Ёж°ҙеҸҚеә”еҲ¶еҸ–ж°ўж°§еҢ–й“қгҖӮ CпјҺеңЁзӣӣжңүNa2O2зҡ„иҜ•з®Ўдёӯе…ҲеҗҺж»ҙе…Ҙж°ҙе’Ңй…ҡй…һжә¶ж¶ІпјҢжҢҜиҚЎпјҢжә¶ж¶ІдёҖзӣҙе‘ҲзәўиүІ DпјҺе°Ҷз”Ёз Ӯзәёжү“зЈЁеҗҺзҡ„й“қз®”еңЁй…’зІҫзҒҜдёҠеҠ зғӯпјҢй“қз®”зҶ”еҢ–ж»ҙиҗҪгҖӮ
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жқЎд»¶дёӢпјҢдёӨзү©иҙЁжүҖеҗ«еҲҶеӯҗж•°дёҚзӣёзӯүзҡ„жҳҜ В В В AпјҺеҗҢжё©еәҰгҖҒзӣёеҗҢиҙЁйҮҸзҡ„N2е’ҢCOгҖҖгҖҖBпјҺеёёжё©еёёеҺӢпјҢеҗҢдҪ“з§Ҝзҡ„H2Oе’ҢO2 В В В CпјҺеҗҢеҺӢејәгҖҒеҗҢзү©иҙЁзҡ„йҮҸзҡ„N2е’ҢO2В В В В DпјҺеҗҢдҪ“з§ҜгҖҒеҗҢеҜҶеәҰзҡ„N2е’ҢCO
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜгҖҖ AпјҺеҫ—з”өеӯҗи¶ҠеӨҡпјҢе…¶ж°§еҢ–жҖ§и¶ҠејәВ В В В BпјҺйҳізҰ»еӯҗеҸӘжңүж°§еҢ–жҖ§пјҢйҳҙзҰ»еӯҗеҸӘжңүиҝҳеҺҹжҖ§ CпјҺиҰҒе®ҢжҲҗSO32-вҶ’SO42-зҡ„иҪ¬еҢ–пјҢеҝ…йЎ»еҠ е…Ҙж°§еҢ–еүӮВ DпјҺйҮ‘еұһе…ғзҙ иў«иҝҳеҺҹж—¶дёҖе®ҡз”ҹжҲҗйҮ‘еұһеҚ•иҙЁ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ AпјҺ78g Na2O2дёҺи¶ійҮҸCO2е……еҲҶеҸҚеә”ж—¶з”өеӯҗиҪ¬з§»ж•°дёә2NA BпјҺеңЁеёёжё©еёёеҺӢдёӢпјҢ11.2 L N2еҗ«жңүзҡ„еҲҶеӯҗж•°жҳҜ0.5NA CпјҺ1mol/L Na2SO4жә¶ж¶ІдёӯзҰ»еӯҗжҖ»ж•°дёә3NA DпјҺ32 g O2еңЁж ҮеҮҶзҠ¶еҶөдёӢзҡ„дҪ“з§ҜзәҰжҳҜ22.4 L
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘеңЁзўұжҖ§жә¶ж¶Ідёӯ100ml 0.2mol/Lзҡ„R(OH)3дёҺ300ml 0.1mol/Lзҡ„ClO- жҒ°еҘҪе®Ңе…ЁеҸҚеә”, R(OH)3иў«ж°§еҢ–дёәRO4n-, ClO-иў«иҝҳеҺҹжҲҗCl- еҲҷRO4n-дёӯRзҡ„еҢ–еҗҲд»·жҳҜ В гҖҖAпјҺ+3В В В В В В BпјҺ+4В В В В В В В В CпјҺ+6В В В В В В В В DпјҺ+7
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҺй«ҳй”°й…ёй’ҫжә¶ж¶ІеңЁй…ёжҖ§жқЎд»¶дёӢеҸҜд»ҘдёҺзЎ«й…ёдәҡй“ҒеҸҚеә”пјҢзҰ»еӯҗж–№зЁӢејҸеҰӮдёӢпјҡ MnO4-пјӢ5Fe2+пјӢ8H+ = Mn2+пјӢ5Fe3+пјӢ4H2OгҖҖдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺMnO4-жҳҜж°§еҢ–еүӮпјҢFe3+жҳҜиҝҳеҺҹдә§зү© BпјҺMn2+зҡ„иҝҳеҺҹжҖ§ејәдәҺFe2+ CпјҺж°§еҢ–жҖ§MnO4- ејәдәҺFe3+ DпјҺз”ҹжҲҗ1 mol ж°ҙж—¶пјҢиҪ¬з§»2.5 molз”өеӯҗ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҺжңүе…із”өи§ЈиҙЁзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺж°ҜеҢ–й’ еңЁз”өжөҒзҡ„дҪңз”ЁдёӢз”өзҰ»еҮәNa+е’ҢCl- BпјҺCO2ж°ҙжә¶ж¶ІиғҪеӨҹеҜјз”өпјҢжүҖд»ҘCO2жҳҜз”өи§ЈиҙЁ CпјҺCaCO3йҡҫжә¶дәҺж°ҙпјҢдҪҶCaCO3еұһдәҺз”өи§ЈиҙЁ DпјҺFeCl3жә¶ж¶ІиғҪеӨҹеҜјз”өпјҢжүҖд»ҘFeCl3жә¶ж¶ІжҳҜз”өи§ЈиҙЁ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зҰ»еӯҗдёҖе®ҡиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ AпјҺеҗ«жңүеӨ§йҮҸCa2+зҡ„жә¶ж¶ІдёӯпјҡCl-гҖҒK+гҖҒSO42-гҖҒCO32- BпјҺдҪҝзҹіи•ҠеҸҳзәўзҡ„жә¶ж¶ІдёӯпјҡMg2+гҖҒNa+гҖҒHCO3-гҖҒSO42- CпјҺдҪҝй…ҡй…һеҸҳзәўзҡ„жә¶ж¶ІдёӯпјҡK+гҖҒNO3-гҖҒSO42-гҖҒCO32- DпјҺж— иүІйҖҸжҳҺзҡ„жә¶ж¶Ідёӯпјҡ H+гҖҒNa+гҖҒFe3+гҖҒNO3-
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜ AпјҺй“ҒдёҺзЁҖзЎ«й…ёеҸҚеә”пјҡ2Fe+6H+=2Fe3++3H2вҶ‘ BпјҺBaCO3 жә¶дәҺйҶӢй…ёпјҡCO32- + 2H+ = Ba2+ + H2O + CO2вҶ‘ CпјҺзЎқ酸银жә¶ж¶ІдёӯеҠ е…Ҙй“ҒзІүпјҡAg++FeпјқFe2++Ag DпјҺеҗ‘Ca (HCO3)2жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸзҡ„NaOHжә¶ж¶Іпјҡ Ca2++2HCO3-+2OH- = CaCO3вҶ“ +CO32-+2 H2O
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗж— иүІйҖҸжҳҺжә¶ж¶Іж”ҫе…Ҙй“қзүҮеҗҺжңүж°ўж°”дә§з”ҹпјҢеңЁиҜҘжә¶ж¶ІдёӯпјҢдёӢеҲ—зү©иҙЁеҸҜиғҪеӨ§йҮҸеӯҳеңЁзҡ„жҳҜ AпјҺNa2CO3 В В В В BпјҺNaHSO3В В В В В CпјҺ(NH4)2CO3В В В В DпјҺAl(OH)3
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
иҙЁйҮҸжҜ”дёә1пјҡ1зҡ„COе’ҢH2з»„жҲҗзҡ„ж··еҗҲж°”дҪ“2.1 gеңЁи¶ійҮҸзҡ„ж°§ж°”дёӯзӮ№зҮғе……еҲҶеҸҚеә”еҗҺпјҢе°Ҷдә§зү©з«ӢеҚійҖҡе…Ҙи¶ійҮҸзҡ„Na2O2еӣәдҪ“дёӯпјҢеӣәдҪ“иҙЁйҮҸеўһеҠ дёә AпјҺ3.6 gВ В В В В В В В BпјҺ2.1gВ В В В В В В В CпјҺ7.2 gВ В В В В В В В DпјҺж— жі•зЎ®е®ҡ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷзү©иҙЁзҡ„йҮҸеқҮдёәamolзҡ„Na е’ҢAlдёҖеҗҢжҠ•е…Ҙmgи¶ійҮҸж°ҙдёӯпјҢжүҖеҫ—жә¶ж¶Ізҡ„еҜҶеәҰдёәПҒgВ·cm-3пјҢеҲҷжӯӨжә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә AпјҺ1000aПҒ/пјҲ46a+mпјүmolВ·L-1В В В В В В В В В В В В BпјҺ4ПҒ/пјҲ46a+mпјүmolВ·L-1 В В В CпјҺ1000aПҒ/пјҲ50a+mпјүmolВ·L-1 В В В В В В В В DпјҺ1000aПҒ/пјҲ45a+mпјүmolВ·L-1
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁеҗ«жңүFe3+гҖҒAl3+гҖҒCl-гҖҒNa+ зҡ„зЁҖжә¶ж¶ІдёӯпјҢеҠ е…Ҙи¶ійҮҸзҡ„Na2O2еӣәдҪ“пјҢе……еҲҶеҸҚеә”еҗҺеҶҚеҠ е…ҘиҝҮйҮҸзҡ„зЁҖзӣҗй…ёпјҢжә¶ж¶ІдёӯзҰ»еӯҗж•°зӣ®еҸҳеҢ–жңҖе°Ҹзҡ„жҳҜ AпјҺAl3+ гҖҒCl-В В В В BпјҺAl3+В гҖҒFe3+ В В В В В CпјҺFe3+гҖҒCl-В В В В DпјҺCl-гҖҒNa+
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
жҠҠCO2йҖҡе…Ҙеҗ«жңүNaOH 0.8gзҡ„зғ§зўұжә¶ж¶ІдёӯпјҢе°Ҷдә§зү©еңЁеҮҸеҺӢдёӢи’ёе№ІеҗҺпјҢеҫ—еҲ°еӣәдҪ“1.37gпјҢеҲҷйҖҡе…ҘCO2зҡ„иҙЁйҮҸжҳҜ В гҖҖAпјҺ0.44gВ В В В В В В В В В BпјҺ0.88gВ В В В В В CпјҺ0.66gВ В В В В В В DпјҺйғҪдёҚжҳҜ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
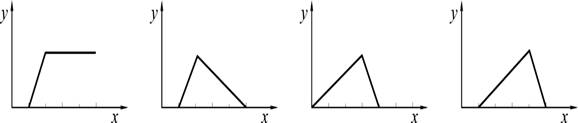
е°ҶNaOHжә¶ж¶ІйҖҗж»ҙеҠ е…ҘеҲ°з”Ёзӣҗй…ёй…ёеҢ–зҡ„AlCl3жә¶ж¶ІдёӯпјҢиӢҘз”ЁyиҪҙиЎЁзӨәAl(OH)3жІүж·Җзҡ„йҮҸпјҢxиҪҙиЎЁзӨәNaOHжә¶ж¶Ізҡ„дҪ“з§ҜпјҢдёӢеҲ—еӣҫиұЎжӯЈзЎ®зҡ„жҳҜ
AВ В В В В В В В В В В В В В В В BВ В В В В В В В В В В В В В В В CВ В В В В В В В В В В В В В В В В D
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷ7.8 gй•Ғй“қеҗҲйҮ‘дёҺ500mlдёҖе®ҡжө“еәҰзҡ„зЁҖзӣҗй…ёе……еҲҶеҸҚеә”еҗҺпјҢйҮ‘еұһж— еү©дҪҷпјҢеҶҚеҗ‘еҸҚеә”еҗҺжә¶ж¶ІдёӯеҠ е…Ҙ400ml 2.5mol/Lзҡ„NaOHжә¶ж¶ІиҮіжІүж·ҖйҮҸиҫҫжңҖеӨ§пјҢиҝҮж»ӨгҖҒжҙ—ж¶ӨгҖҒе№ІзҮҘпјҢз§°йҮҸжүҖеҫ—еӣәдҪ“иҙЁйҮҸдёә21.4 gпјҢеҲҷдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ AпјҺжІүж·ҖжңҖеӨ§ж—¶жүҖеҫ—еӣәдҪ“дёәMg(OH)2 гҖҒAl(OH)3В В В В В В В BпјҺдә§з”ҹж°ўж°”ж ҮеҶөдёӢдҪ“з§Ҝдёә8.96L CпјҺеҗҲйҮ‘дёӯй•Ғй“қиҙЁйҮҸжҜ”дёә1 : 2 В В В В В В В В В В В В В В В В В В В В В В В DпјҺзӣҗй…ёзҡ„жө“еәҰдёә 2 mol/L
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
й’ е’Ңй’ зҡ„еҢ–еҗҲзү©жңүи®ёеӨҡйҮҚиҰҒзҡ„з”ЁйҖ”гҖӮ пјҲ1пјүзўій…ёй’ еҸҜз”ЁдәҺд»Һжө·ж°ҙжҸҗеҸ–жәҙпјҢж¶үеҸҠзҡ„еҸҚеә”еҰӮдёӢпјҡ 3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3 еңЁдёҠиҝ°еҸҚеә”дёӯз”ЁеҸҢзәҝжЎҘжі•ж ҮеҮәз”өеӯҗиҪ¬з§»зҡ„ж–№еҗ‘е’Ңж•°зӣ®В В В В В В В В В В В В В В пјӣ иҜҘеҸҚеә”дёӯж°§еҢ–еүӮдёҺиҝҳеҺҹеүӮзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”жҳҜ В В В В В В В В В В пјҲ2пјүе°‘йҮҸзҡ„й’ еә”дҝқеӯҳеңЁВ В В В В В В В дёӯпјӣй’ зқҖзҒ«ж—¶еә”йҮҮеҸ–зҡ„зҒӯзҒ«жҺӘж–ҪжҳҜВ В В В В В пјҲ3пјүиҝҮж°§еҢ–й’ дҪңжҪңиүҮдҫӣж°§еүӮж—¶еҸ‘з”ҹзҡ„еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸжҳҜВ В В В В В В В В В В В В В В В В пјӣиҜҘеҸҚеә”зҡ„ж°§еҢ–дә§зү©жҳҜВ В В В В В В В В В В В гҖӮ пјҲ4пјүеҺЁжҲҝдёӯеӯҳж”ҫзҡ„зәҜзўұе’Ңе°ҸиӢҸжү“ж— жі•з”ЁеӨ–и§ӮеҢәеҲ«ж—¶пјҢиҜ·дҪ и®ҫи®Ўз”ЁеҺЁжҲҝзҺ°жңүзҡ„зү©иҙЁжқҘеҢәеҲҶе®ғ们зҡ„ж–№жі•________________________________
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ |
|
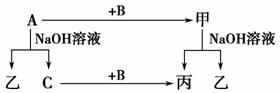
ж №жҚ®еӣҫзӨәиҪ¬еҢ–е…ізі»еӣһзӯ”пјҡ пјҲ1пјүеҶҷеҮәдёӢеҲ—зү©иҙЁзҡ„еҢ–еӯҰејҸгҖӮ A________пјҢB________пјҢз”ІВ В В В В В В В пјҢд№ҷ________гҖӮ пјҲ2пјүеҶҷеҮәдёӢеҲ—еҸҳеҢ–зҡ„еҢ–еӯҰж–№зЁӢејҸгҖӮ в‘ AдёҺNaOHжә¶ж¶ІеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ________________________________гҖӮ в‘Ўз”ІдёҺNaOHжә¶ж¶ІеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ________________________________гҖӮ пјҲ3пјүе°ҶдёҖе®ҡйҮҸзҡ„AеҠ е…ҘеҲ°NaOHжә¶ж¶ІдёӯпјҢдә§з”ҹзҡ„CеңЁж ҮеҮҶзҠ¶еҶөдёӢзҡ„дҪ“з§Ҝдёә3.36 LпјҢеҲҷж¶ҲиҖ—зҡ„Aзҡ„зү©иҙЁзҡ„йҮҸдёә________пјҢиҪ¬з§»з”өеӯҗзҡ„зү©иҙЁзҡ„йҮҸдёә________гҖӮ
|
|
| 27. | иҜҰз»ҶдҝЎжҒҜ |
|
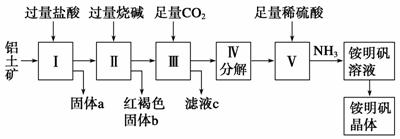
й“қжҳҜйҮҚиҰҒзҡ„йҮ‘еұһжқҗж–ҷпјҢй“қеңҹзҹҝ(дё»иҰҒжҲҗеҲҶжҳҜAl2O3е’Ңе°‘йҮҸзҡ„SiO2гҖҒFe2O3жқӮиҙЁ)жҳҜе·ҘдёҡдёҠеҲ¶еҸ–й“қзҡ„еҺҹж–ҷгҖӮе®һйӘҢе®ӨжЁЎжӢҹе·ҘдёҡдёҠд»Ҙй“қеңҹзҹҝдёәеҺҹж–ҷеҲ¶еҸ–Al2(SO4)3е’Ңй“өжҳҺзҹҫжҷ¶дҪ“[NH4Al(SO4)2В·12H2O]зҡ„е·ҘиүәжөҒзЁӢеҰӮеӣҫжүҖзӨәпјҡ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүеӣәдҪ“aзҡ„еҢ–еӯҰејҸдёә________гҖӮ пјҲ2пјүеҶҷеҮәв…ЎдёӯеҠ иҝҮйҮҸзҡ„зғ§зўұж¶үеҸҠеҲ°зҡ„еҸҚеә”зҰ»еӯҗж–№зЁӢејҸВ В В В В В В В В В В В В гҖҒВ В В В В В В В В В В В пјӣв…ўдёӯйҖҡе…Ҙи¶ійҮҸCO2ж°”дҪ“еҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В гҖӮ пјҲ3пјүз”ұв…ўдёӯеҫ—еҲ°ж»Өж¶ІCзҡ„е®һйӘҢж“ҚдҪңдёә_______В _пјҢд»Һй“өжҳҺзҹҫжә¶ж¶ІдёӯиҺ·еҫ—й“өжҳҺзҹҫжҷ¶дҪ“зҡ„е®һйӘҢж“ҚдҪңдҫқж¬Ўдёә(еЎ«ж“ҚдҪңеҗҚз§°)________гҖҒеҶ·еҚҙз»“жҷ¶гҖҒиҝҮж»Өжҙ—ж¶ӨгҖӮ пјҲ4пјүж»Өж¶ІCжҳҫВ В В В В В В жҖ§пјҢж—Ҙеёёз”ҹжҙ»дёӯеёёз”Ёе…¶жә¶иҙЁжқҘВ В В В В В В В В В В В В В В пјҲд»»еҶҷдёҖзӮ№пјүпјӣ пјҲ5пјүиӢҘеҗҢж—¶еҲ¶еҸ–й“өжҳҺзҹҫе’ҢзЎ«й…ёй“қпјҢйҖҡиҝҮжҺ§еҲ¶зЎ«й…ёзҡ„з”ЁйҮҸи°ғиҠӮдёӨз§Қдә§е“Ғзҡ„дә§йҮҸгҖӮиӢҘж¬ІдҪҝеҲ¶еҫ—зҡ„й“өжҳҺзҹҫе’ҢзЎ«й…ёй“қзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә1вҲ¶1пјҢеҲҷжҠ•ж–ҷж—¶й“қеңҹзҹҝдёӯзҡ„Al2O3е’ҢH2SO4зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә________гҖӮ
|
|
| 28. | иҜҰз»ҶдҝЎжҒҜ |
|
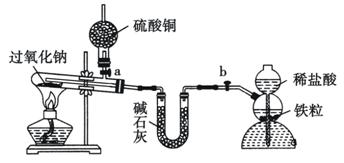
Na2O2жҳҜдёӯеӯҰеҢ–еӯҰеёёз”Ёзҡ„ејәж°§еҢ–еүӮпјҢйҷӨдәҶиғҪдёҺCO2гҖҒH2OеҸҚеә”еӨ–пјҢиҝҳеҸҜдёҺе…¶д»–иҝҳеҺҹеүӮеҰӮH2гҖҒCеҸ‘з”ҹеҸҚеә”пјҢжҹҗеҢ–еӯҰиҜҫеӨ–е…ҙи¶Је°Ҹз»„дёәжҺўз©¶Na2O2дёҺH2зҡ„еҸҚеә”жғ…еҶөпјҢи®ҫи®ЎдәҶеҰӮдёӢеӣҫжүҖзӨәиЈ…зҪ®иҝӣиЎҢжңүе…іе®һйӘҢгҖӮ
пјҲ1пјүжӯӨиЈ…зҪ®дёӯпјҢжҖҺж ·жЈҖжҹҘйҷӨеҗҜжҷ®еҸ‘з”ҹеҷЁд№ӢеӨ–зҡ„иЈ…зҪ®зҡ„ж°”еҜҶжҖ§пјҹ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүиҜ·е®ҢжҲҗиҜҘе®һйӘҢзҡ„жңүе…іж“ҚдҪңжӯҘйӘӨгҖӮ в‘ жЈҖжҹҘиЈ…зҪ®ж°”еҜҶжҖ§пјӣ в‘Ўжү“ејҖaгҖҒbдә§з”ҹж°ўж°”пјҢи§ӮеҜҹиҜ•з®ЎеҶ…зү©иҙЁзҡ„йўңиүІеҸҳеҢ–пјӣ в‘ў____________________________________________________пјӣ в‘ЈеҠ зғӯиҝҮж°§еҢ–й’ пјҢи§ӮеҜҹиҜ•з®ЎеҶ…зү©иҙЁзҡ„йўңиүІеҸҳеҢ–пјӣ в‘ӨеҸҚеә”е®Ңе…ЁеҗҺпјҢ__________________________________________пјӣ в‘ҘжӢҶеҚёиЈ…зҪ®гҖӮ пјҲ3пјүиҜҘиЈ…зҪ®дёӯпјҢзўұзҹізҒ°зҡ„дҪңз”ЁжҳҜ_________________________ гҖӮ пјҲ4пјүе®һйӘҢиҝҮзЁӢдёӯи§ӮеҜҹеҲ°(2)дёӯжӯҘйӘӨв‘Ўж— жҳҺжҳҫеҸҳеҢ–пјҢжӯҘйӘӨв‘ЈNa2O2зҶ”еҢ–еҗҺпјҢй»„иүІзІүжң«з«ӢеҚіеҸҳжҲҗзҷҪиүІпјҢе№ІзҮҘз®ЎеҶ…зЎ«й…ёй“ңжңӘеҸҳжҲҗи“қиүІгҖӮеҲҷNa2O2дёҺH2еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә__________________________________гҖӮ
|
|
- е…ЁеӣҪй«ҳдёүеҢ–еӯҰдё“йўҳз»ғд№ пјҲ2019е№ҙдёӢеҶҢпјүзҪ‘з»ңиҖғиҜ•иҜ•еҚ·
- йІҒ科зүҲйҖүжӢ©жҖ§еҝ…дҝ®1第2з« еҢ–еӯҰеҸҚеә”зҡ„ж–№еҗ‘гҖҒйҷҗеәҰдёҺйҖҹзҺҮ第1иҠӮеҢ–еӯҰеҸҚеә”зҡ„ж–№еҗ‘
- е…ғйҳіеҺҝ第дёүдёӯеӯҰй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•иҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- 2018-2019е№ҙй«ҳдәҢдёҠеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲеҶ…и’ҷеҸӨиҮӘжІ»еҢәеҢ…еӨҙеёӮ第е…ӯдёӯеӯҰпјү
- жҲҗйғҪиүәжңҜй«ҳзә§дёӯеӯҰй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҲиҖғиҜ•еҚ·йўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- е…ЁеӣҪ2019е№ҙй«ҳдёҖеҗҺеҚҠжңҹеҢ–еӯҰиҜҫж—¶з»ғд№ йҷ„зӯ”жЎҲдёҺи§Јжһҗ
- 2019пјҲдё“йўҳ8 дё“йўҳејәеҢ–з»ғ4 зғғзҡ„з»“жһ„е’ҢжҖ§иҙЁ-й«ҳдёӯеҢ–еӯҰеҝ…дҝ®з¬¬дәҢеҶҢиӢҸж•ҷзүҲпјү
- еҸ°еұұеёӮе®Ңж•ҙиҜ•еҚ·