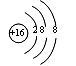2018江苏高二下学期苏教版高中化学学业考试
| 1. | 详细信息 |
|
“一带一路”分别指的是“丝绸之路经济带”和“21世纪海上丝绸之 A.糖类 B.蛋白质 C.油脂 D.无机盐
|
|
| 2. | 详细信息 |
|
“Pu-239”是“于敏型”氢弹的重要原料。 A.51 B.94
|
|
| 3. | 详细信息 |
|
下列有关物质分类的说法中正确的是 A.石油、煤、苏打都是混合物 B .烧碱、纯碱、碱石灰都是碱 C.明矾、胆矾、小苏打都是盐 D .HCl、H2SO4、NH3都是酸
|
|
| 4. | 详细信息 |
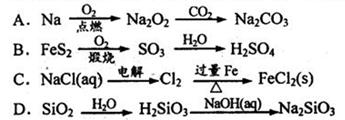
|
“民以食为天,食以安为先”。下列做法会危害食品安全的是 A.回收餐桌废油加工成化工原料 B.给蔬菜瓜果喷洒甲醛溶液 C.在熟食中加适量的食品添加剂 D.食盐加碘、酱油加铁
|
|
| 5. | 详细信息 |
|
下列化学用语正确的是
C.电离方程式:NaHCO3=Na++H++CO32- D.S2-的结构示意图如右:
|
|
| 6. | 详细信息 |
|
下列物质中既含有离子键又含有共价键的是 A.MgCl2 B.NH4Cl C.H2SO4 D. H2O
|
|
| 7. | 详细信息 |
|
下列各组物质中,互为同系物的是 A.612C和613C B.NH4CNO 和 CO(NH2)2 C.CH4和C2H6 D.金刚石和石墨
|
|
| 8. | 详细信息 |
|
下列关于苯的说法正确的是( ) A. 苯分子中无碳碳双键,苯不能发生加成反应 B. 能使酸性KMnO4溶液褪色 C. 可发生取代反应 D. 与右图物质互为同系物
|
|
| 9. | 详细信息 |
|
下列物质中能够用来鉴别乙醇、乙酸和苯的是 A.溴水 B.氢氧化钠溶液 C.水 D.紫色
|
|
| 10. | 详细信息 |
|
在给定
|
|
| 11. | 详细信息 |
|
下列有关浓硝酸的说法中错误的是 A. 浓HNO3能与碳反应,说明其具有强氧化性 B. 浓HNO3能溶解金属铜,说明其具有强酸性 C. 浓HNO3不稳定易分解,需要避光保存 D. 常温下浓HNO3能使金属铝钝化,可以用铝槽车运输浓HNO3
|
|
| 12. | 详细信息 |
|
三氟化氮(NF3)是微电子工业技术创新必不可少的关键原料之一,可由氨气和氟气反应得到:4NH3+3F2 = NF3+3NH4F,下列有关该反应的说法中正确的是 A.该反应是复分解反应 B.氮元素化合价不变 C.NH3发生还原反应 D.F2是氧化剂
|
|
| 13. | 详细信息 |
|
下列过程放出热量的是 A. 液氨气化 B. 钠与水反应 C. 碳酸钙分解 D. 化学键的断裂
|
|
| 14. | 详细信息 |
|
A. 增大压强可加快该反应速率 B. 升高温度能加快该反应速率 C. 增大H2的浓度能加快该反应速率 D. 密
|
|
| 15. | 详细信息 |
|
下列反应的离子方程式正确的是 A.碳酸钙跟盐酸反应: B.氨水跟盐酸反应: C.氢氧化钡跟足量的硫酸氢钠稀硫酸反应: D.醋酸溶液与氢氧化钠溶液反应:
|
|
| 16. | 详细信息 | |||
|
下列有机反应方程式书写错误的是 A. B. CH2===CH2+H2O C. 2CH3CHO+O2 D. CH4+Cl2
|
||||
| 17. | 详细信息 |
|
下列有关物质用途的说法错误的是 A. 氢氧化铁胶体可用于净水 B. Fe2O3可用作红色涂料 C. 纯碱溶液可用于去除油污 D. MnO2和浓HCl可用于工业制氯气
|
|
| 18. | 详细信息 |
|
用NA表示阿伏加德罗常数的值。下列判断正确的是 A. 常温常压下,16 g O3和 O2和混合气体所含 B. 1 mol·L-1CaCl2溶液中含有的Cl-数目为2NA C. 5.6 g Fe与足量盐酸反应失去的电子数目为0.3NA D. 标准状况下,22.4 LSO3含有的分子数目为NA
|
|
| 19. | 详细信息 |
|
下列各组离子在溶液中可以大量共存的是 A.Ba2+、NO3-、OH- C.Cu2+、CO32-、Cl- D.Fe3+、Na+、SCN-
|
|
| 20. | 详细信息 |
|
实验室处理废催化剂FeBr3溶液,得到溴的苯溶液和无水FeCl3。下列设计能达到相应实验目的的是 A.用装置甲制取氯气 B.用装置乙使Br-全部转化为溴单质 C.用装置丙分液时先从下口放出水层,再从上口倒出有机层 D.用装置丁将分液后的水层蒸发至干,再灼烧制得无水FeCl3
|
|
| 21. | 详细信息 |
|
锌空气电池(右图)具有蓄电量大、充电循环次数多等优点。下列有关说法错误的是 A. 电池放电时Zn电极逐渐溶解 B. 石墨为正极 C. 电子由石墨经导线流向Zn片 D. 电池放电时实现了化学能向电能的转化
|
|
| 22. | 详细信息 |
|
X、Y、Z都是第三周期元素,核电荷数 A.X是第ⅠA元素 B.Z可能是第ⅥA C.X、Y、Z三种元素的最高化合价依次增大 D.X、Z形成的化合物既可以是离子化合物,又可以是共价化合物
|
|
| 23. | 详细信息 |
|
2.48 g铁铜合金完全溶解于80 mL 4.0 mol·L-1稀硝酸中,得到标准状况下672 mL NO气体(假设此时无其他 A. 取反应后溶液,滴入几滴KSCN溶液,无血红色出现 B. 该合金中铁与铜的物质的量之比是1∶2 C. 向反应后的溶液中加入2.0 mol·L-1NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是120 mL D.反应后溶液(忽略溶液体积变化)中c(H+)=2.5 mol·L-1
|
|
| 24. | 详细信息 |
|
(1) (5分)2016年我国GDP连续三季度涨速均达到6.7%,随着人们生活水平的提高,人们越来越关注营养平衡和自身的健康。 ①粮食中的淀粉在人体中水解最终转化成__________,该物质在人体内被氧化,最终生成CO2和H2O,该过程对人体健康的意义是____________________________________。 ②食品添加剂亚硝酸钠的外观像食盐,并有咸味,但亚硝酸钠有很强的毒性。亚硝酸钠属于________(填“调味剂”、“防腐剂”或“着色剂”)。 ③维生素C也称抗坏血酸。血液中运载氧的血红蛋白中含有Fe2+,人之所以患坏血病,是因为人体从摄取的食物中吸收的铁主要是F ④.下列有关物质的叙述不正确的是( ) A.食物溶于水后的溶液中pH小于7,则为酸性食物 B.碘酒可使细菌、病毒蛋白质变性而死亡 C.氨基酸是两性化合物,能与酸或碱反应生成盐 D.油脂均不能发生加成反应.但能在一定条件下发生水解反应 (2) (5分)中国是世界上最早研究和生产合金的国家之一。 ①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点__________。 ②铜锌合金外观和金(Au)相似,常被误认为黄金。试写出一种鉴别黄铜与黄金的化学方法:______________________ ③下列 A. 在电线的外面包上一层塑料层 B. 在自行车钢圈上镀上一层金属铬 C. 在海轮的铁制外壳上焊上铜块 (3) (5分)①CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。请你写出有利于降低大气中CO2浓度的一项措施____________。 ②水中含有的悬浮颗粒物等杂质,可以加入______________等混凝剂进行净化处理,利用其溶解后形成的__________具有吸附作用使水中的悬浮颗粒物沉降。 ③最近,国内第一个跨区域日处理垃圾1 000吨以上的垃圾焚烧发电厂在江苏投入使用。下面列出了现代生活中的常见垃圾: A. 废纸 B. 废电池 C. 易拉罐 D. 玻璃瓶 E. 塑料制品 在焚烧处理前,除废电池外,还有____________(填字母)应剔除并回收,随意丢弃电池造成的主要危害是________________________________。
|
|
| 25. | 详细信息 |
|
有关物质的转化关系如下图所示。A是黑色非金属单质,C、E、F均为氧化物,E、F常温下呈气态,且E能使品红褪色,G是一种常见的无色液体,I是一种难溶于水的白色胶状沉淀,能溶于B溶液。请回答下列问题:
(1) C (2) G的电子式为_______ (3) 写出①反应的化学方程式:________ 。 (4) 写出过量的F参加反应时②的离子方程式:________ 。
|
|
| 26. | 详细信息 |
|
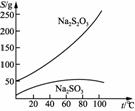
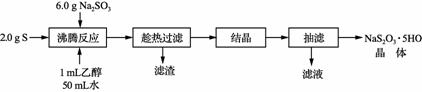
Na2S2O3·5H2O是常用的脱氧剂、定影剂和还原剂。它是无色易溶于水的晶体,不溶于乙醇,Na2S2O3·5H2O在40~45℃熔化,48℃分解。下图是有关物质的溶解度曲线:
已知:Na2SO3+S
(1) 趁热过滤的原因是____________。趁热过滤后滤渣的主要成分是___________ (2) 结晶的方法是____________(填“冷却结晶”或“蒸发结晶”)。 (3) 洗涤抽滤后得到的晶体,可采用的洗涤液是________。 A. 水 B. 饱和NaCl溶液 C.无水乙醇 (4) 工业上制得的Na2S2O3·5H2O产品中含有少量的Na2SO3和Na2SO4杂质。为测定产品成分的含量,准确称取3.016 g样品,加入蒸馏水完全溶解后配成溶液。将配成的溶液平均分成两份。向一份溶液中加入适量甲醛溶液预处理(防止Na2SO3在碱性条件下与I2反应),然后向其中加入0.050 0 mol·L-1 I2溶液,发生反应:2S2O 已知:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O Na2SO3+H2SO4===Na2SO4+SO2↑+H2O (Na2S2O3·5H2O 248 g·mol-1 Na2SO3 126 g·mol-1 Na2SO4 142 g·mol-1) ①写出Na2SO3在碱性条件下与I2反应的离子方程式______________。 ②3.016 g样品中Na2S2O3·5H2O质量分数是________。 ③3.016 g样品中含有Na2SO4的物质的量是________。
|
|