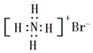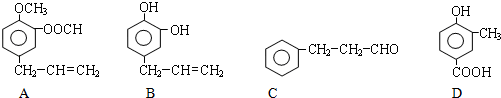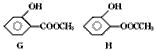2019辽宁高二下学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于要Y的说法错误的是( ) A. Y属于金属元素 B. C. D.
|
|
| 2. | 详细信息 |
|
下列分子含有的电子数目与HF相同,且是含极性键的非极性分子的是( ) A. CO2 B. N2O C. H2O D. CH4
|
|
| 3. | 详细信息 |
|
下列有关化学用语正确的说法是( ) A. B. 硫离子的结构示意图: C. 原子核内有16个中子的磷原子: D. 二氧化硅的分子式为:SiO2
|
|
| 4. | 详细信息 |
|
已知33As、35Br位于同一周期.下列关系正确的是( ) A. 原子半径:As>Cl>P B. 还原性:As3﹣>S2﹣>Cl﹣ C. 热稳定性:HCl>AsH3>HBr D. 酸性:H3AsO4>H2SO4>H3PO4
|
|
| 5. | 详细信息 |
|
已知阴离子A2﹣的原子核内有x个中子,A原子的质量数为m,则Wg A2﹣ 含有电子的物质的量为( ) A. B. C. D.
|
|
| 6. | 详细信息 |
|
下列分子中,键角最小的是( ) A. CO2 B. BF3 C. NH3 D. H2O
|
|
| 7. | 详细信息 |
|
下列对价电子构型为2s22p5的元素描述正确的是( ) A. 电负性最大 B. 最高正价为+7 C. 第一电离能最大 D. 原子半径最小
|
|
| 8. | 详细信息 |
|
原子序数为83的元素位于:①第5周期;②第6周期;③ⅣA族;④ⅤA族;⑤ⅡB族.其中正确的组合是( ) A. ①④ B. ②③ C. ②④ D. ①⑤
|
|
| 9. | 详细信息 |
|
X、Y、Z、W均为短周期元素且原子序数依次增大,其中Y、W同主族;常温下,Y、W的单质为有色气体, W气体同冷烧碱溶液作用,可得到含ZWX的盐溶液.下列说法中正确的是( ) A. Z2X2 中阴阳离子个数比为1:1 B. 元素X和W的某些单质可作为水处理中的消毒剂 C. 原子半径大小为X<Y<Z<W D. Y的氢化物水溶液酸性强于W的
|
|
| 10. | 详细信息 |
|
下列说法正确是( ) A. 分子晶体中都存在共价键;晶体中只要有阳离子就一定有阴离子 B. 酸性HClO4>H3PO4,是因为HClO4分子非羟基氧原子数目比H3PO4多 C. HF稳定性很强, D. 乳酸[CH3CH(OH)COOH]分子中有2个手性碳原子
|
|
| 11. | 详细信息 |
|
元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
A. D在过量的B中燃烧的主要产物为DB3 B. D的两种常见氧化物均为极性分子 C. AC4 分子的空间立体构型为正四面体形 D. E的氧化物对应的水化物一定是一种强酸
|
|
| 12. | 详细信息 |
|
下列化合物中阴离子半径和阳离子半径之比最大的是( ) A. LiI B. NaBr C. KCl D. CsF
|
|
| 13. | 详细信息 |
|
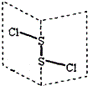
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构中每个原子均满足8电子结构。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是( )
A. S2Cl2中的硫元素显+1价 B. S2Cl2中含极性键和非极性键,是非极性分子 C. S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 D. S2Cl2与H2O反应的生成物中可能有S
|
|
| 14. | 详细信息 |
|
根据价层电子对互斥理论,中心原子杂化轨道类型为sp2的微粒为( ) A. CH3Cl B. SO32﹣ C. NF3 D. CO32﹣
|
|
| 15. | 详细信息 |
|
.短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X、Y、W、Q四种元素的原子最外层电子数之和为23。则下列说法中正确的是( )
A. 钠与W形成的化合物Na2W2中既含离子键又含非极性共价键 B. 由Z与Y组成的物质在熔融时能导电 C. 氢化物的沸点:Y<Q D. X有多种同素异形体,而Y不存在同素异形体
|
|
| 16. | 详细信息 |
|
已知MgCO3、CaCO3、SrCO3、BaCO3受热均要分解。下列说法不正确的是( ) A. 上述四种盐的晶体均属于离子晶体 B. 分解所得金属氧化物晶格能最大的是MgO C. 分解所需温度最低的是BaCO3 D. 所得的气态产物的VSEPR模型是直线形
|
|
| 17. | 详细信息 |
|
.CoCl3·4NH3用H2SO4溶液处理再结晶,SO42-可以取代化合物中的Cl-,但NH3的含量不变,用过量的AgNO3处理该化合物,有含量三分之一的氯以AgCl析出,这种化合物应该是( ) A. [Co(NH3)4]Cl3 B. [Co(NH3)4Cl3] C. [Co(NH3)4Cl2]Cl D. [Co(NH3)4Cl]Cl2
|
|
| 18. | 详细信息 |
|
下列几组顺序排列不正确的是( ) A. 还原性强弱:HI>HBr>HCl>HF B. 热稳定性大小:HF>H2O>NH3>PH3 C. 熔点高低:金刚石>食盐>金属钠>冰 D. 微粒半径大小:Na+>Al3+>F﹣>O2-
|
|
| 19. | 详细信息 |
|
氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子构型为平面三角形,则其阳离子的构型和阳离子中氮的杂化方式为( ) A. 平面三角形 sp2杂化 B. V形 sp2杂化 C. 三角锥形 sp3杂化 D. 直线形 sp杂化
|
|
| 20. | 详细信息 |
|
干冰在一定条件下可以形成CO2气体,CO2气体在一定条件下又可以与金属镁反应生成氧化镁和碳,这两个变化过程中需要克服的作用力分别是( ) A. 分子间作用力,化学键 B. 化学键,化学键 C. 化学键,分子间作用力 D. 分子间作用力,分子间作用力
|
|
| 21. | 详细信息 |
|
科学家从化肥厂生产的(NH4)2SO4中检出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42- 和N4H44+ 两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。请回答下列问题:
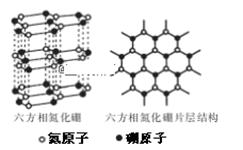
(1)下列相关说法中,正确的是________(填序号)。 a.N4是N2的同分异构体 b.1 mol N4分解生成N2,形成了4 molπ键 c.白磷的沸点比N4高,是因为P-P键键能比N-N键能大 d.白磷的化学性质比N2活泼,说明P的非金属性比N强 (2)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3)等。根据等电子体理论写出N3- 的电子式_______;叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钴显 ____ 价,它的配体是 __________ (3)六方相氮化硼晶体内B-N键数与硼原子数之比为_______。
|
|
| 22. | 详细信息 |
|
按要求填空: (1)金刚石、晶体硅、碳化硅,属于____晶体,其熔化时克服的微粒间的作用力是______。 (2)HF、HBr、HI形成的晶体,沸点由高到低的顺序为:_______________。 (3)NH3易液化,解释原因:_______,NH3分子的空间构型为____________。 (4)MgO的熔点比CaO的高,其原因是___________。
|
|
| 23. | 详细信息 |
|
Q、R、X、Y、Z五种元素的原子序数依次递增。 已知:①Z的原子序数为29,其余的均为短周期主族元素; ②Y原子价电子(外围电子)排布为msnmpn; ③Q、X原子p能级的电子数分别为2和4。请回答下列问题: (1)Z2+的核外电子排布式是___;基态Q原子的价电子排布图为_____。 (2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是____(填字母)。 a.稳定性:甲>乙 b.沸点:甲<乙 (3)Q、R、X三种元素的第一电离能数值由小至大的顺序为_____(用元素符号作答)。 (4)五种元素中,电负性最大的非金属元素是___,电负性最小的非金属元素是___。(用元素符号作答)。
|
|
| 24. | 详细信息 |
|
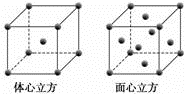
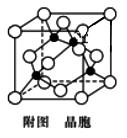
(1)Fe(CO)5中铁的化合价为0,写出铁原子的简化的基态电子排布式______,Fe在周期表中第______周期______族,属于_______区。 (2)已知Fe(CO)5常温下呈液态,熔点为﹣20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体为________(填晶体类型)。 (3)金属铁单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。
体心立方晶胞和面心立方晶胞中实际含有的铁原子个数之比为________;Fe原子配位数之比为____。若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞密度之比为_______。 (4)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如图所示(黑点代表铜原子,空心圆代表Y原子)。
①该晶体的化学式为________。(用元素符号表示) ②已知该晶体的密度为ρ g/cm3,阿伏加德罗常数为NA,则该晶胞边长为______nm(只写计算式)。
|
|
| 25. | 详细信息 |
|
A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料,它们的结构简式如下所示:
请回答下列问题: (1)用A、B、C、D填空: ①既能使FeCl3溶液显色又能和NaHCO3溶液反应放出气体的有__________。 ②能发生银镜反应的有__________。 (2)1molB最多能与_____molBr2发生反应,C中所含官能团的名称为________; (3)按下图C经一步反应可生成E,E是B的同分异构体.则反应①属于____________反应
E到F转化过程中除用到催化剂外,还用到一种试剂G是_________(写结构简式) (4)写出反应①的化学方程式:________;反应②的化学方程式:_________。 (5)同时符合下列两项要求的D的同分异构体有4种: ①化合物是1,2-二取代苯; ②苯环上的两个取代基分别为羟基和含有-COO-结构的基团。 其中两种(G和H)结构简式如下图所示,请补充另外两种。
____________、______________
|
|