2017广西高一下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列关于原子结构、元素性质的说法正确的是( ) A.非金属元素组成的化合物中只含共价键 B.ⅠA族金属元素是同周期中金属性最强的元素 C.同种元素的原子均有相同的质子数和中子数 D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
|
|
| 2. | 详细信息 |
|
下列有关化学键的叙述,正确的是 A.离子化合物中一定含有离子键 B.单质分子中均不存在化学键 C.含有极性键的分子一定是极性分子 D.含有共价键的化合物一定是共价化合物
|
|
| 3. | 详细信息 |
|
下列有关碱金属铯(Cs)的叙述中,正确的是( ) A. Cs 2CO3易溶、但不易电离 B.Rb位于周期表第五周期第ⅠA族 C.在钠、钾、铷、 D.氢氧化铯和盐酸反应的离子方程式是OH-+H+
|
|
| 4. | 详细信息 |
|
下列叙述错误的是( ) A.13C和14C属于同一种元素,它们互为同位素 B.1H和2H是不同的核素,它们的质子数相等 C.14C和14N的质量数相等,它们的中子数不等 D.6Li和7Li的电子数相等,中子数也相等
|
|
| 5. | 详细信息 |
|
氢气能在某黄绿色的单质气体中安静的燃烧,该单质所含元素位于元素周期表的 A.第二周期ⅤA族 B.第三 C.第三周期ⅥA族 D.第三周期ⅦA族
|
|
| 6. | 详细信息 |
|
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图。下列说法正确的是( ) A.Y、Z的常见氧化物可通过加入过量的NaOH溶液来分离 B.其氢化物的稳定性由弱到强的顺序是Q、W、Z C.元素Y、Z、W、Q的原子半径依次增大 D.Y单质做的容器可盛装W的最高价氧化物对应的水化物的浓溶液
|
|
| 7. | 详细信息 |
|
某粒子含有6个质子,7个中子,电荷为0,则它的化学符号是( ) A. 136Al B.136Al C.13 6 C D. 136C
|
|
| 8. | 详细信息 |
|
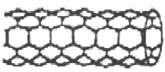
由碳原子构成的纳米碳管可以作为储存氢气的优良容器,其单层部分结构示意图如图所示,下列说法正确的是( ) A.纳米碳管是一种无机化合物 B.纳米碳管中碳原子间以共价键结合
D.0.12 g纳米碳管中含有6.02×l022个碳原子
|
|
| 9. | 详细信息 |
|
在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是( )。 A.制催化剂的材料 B.耐高温、耐腐蚀的合金材料 C.制农药的材料 D.半导体材料
|
|
| 10. | 详细信息 |
|
下列递变规律不正确的是( )。 A.Na、Mg、Al还原性依次减弱 C.C、N、O原子半径依次增大 D.P、S、Cl最高正价依次升高
|
|
| 11. | 详细信息 |
|
X元素的阳离子和Y元素的阴离子具有相同的核外电子结构,下列叙述正确的是( )。 A.原子序数:X<Y B.原子半径:X<Y C.离子半径:X>Y D.原子最外层电子数:X<Y
|
|
| 12. | 详细信息 |
|
.在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( ) A.2Na2O2+2H2O B.Mg3N2+6H2O C.Cl2+H2O D.NH4Cl+NaOH
|
|
| 13. | 详细信息 |
|
.门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是 A.X单质不易与水反应 B.XO2可被碳或氢还原为X C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
|
|
| 14. | 详细信息 |
|
下列物质的变化过程中,有共价键明显被破坏的是( ) A.I2升华 B.NaCl颗粒被粉碎 C.H2SO4溶于水得硫酸溶液 D.NaOH受热熔化
|
|
| 15. | 详细信息 |
|
下列各组中每种物质都既有离子键又有共价键的一组是( ) A. NaOH H2SO4 (NH4+)2SO4 B.MgO Na2SO4 HNO3 C.Na2O2 KOH Na3PO4 D.HCl Al2O3 MgCl2
|
|
| 16. | 详细信息 |
|
有X、Y、Z、W四种元素,它们的原子序数分别为6、10、11、17,下列判断错误的是( ) A.X和W能形成共价化合物 B.Z和W能形成离子化合物 C.Y和Z不能形成化合物 D.Y分子中存在共价键
|
|
| 17. | 详细信息 |
|
在下列变化过程中,属于“破坏极性键和非极性键”→形成“极性键和非极性键”过程的是( ) A.冰→ 水 →水蒸气 → H2 和O2 B. 2Na+Cl2==2NaCl C.2H2+O2==2H2O D. 2H2O2==2H2O+ O2↑
|
|
| 18. | 详细信息 |
|
高氯酸铵为“神舟八号”提供轨道舱气体,高氯酸铵是一种火箭燃烧的重要载氧体,化学式为NH4ClO4,下列有关叙述不正确的是( ) A.高氯酸铵为离子化合物 B.高氯酸铵中只含有离子键 C.高氯酸铵中既有离子键又有共价键 D.高氯酸铵中阴、阳离子的个数比为1∶1
|
|
| 19. | 详细信息 |
|
.A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B、D同周期,C、D同主族, A的原子结构示意图为: (1)A元素符号是________;D元素在元素周期表中位于 (2)用电子式表示B C 2的 形成过程 (3)D的氢化物可与B
|
|
| 20. | 详细信息 |
|
(16分)某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。 Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈; 与盐酸反应产生的气体最多。 (2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S 强,反应的离子方程式为 。 Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律 (3)仪器B的名称为 ,干燥管D的作用为 。 (4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾 溶液吸收尾气。 (5)若要证明非金属性:N>C>Si,则在A中加 、B中加碳酸钙、C中加 溶液观察到C中溶液________的现象,即可证明。但有的同学认为该装置有缺陷应怎样改进 。
|
|
| 21. | 详细信息 | ||||||||||||||||||
|
元素周期表是学习化学的重要工具,它隐含着许多信息和规律。 下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
(1)用元素代号标出它们在周期表中对应位置(以下为周期表的一部分)。
(2)B元素处于周期表中第 周期第 族。 (3)C、D的简单离子的半径由大到小顺序为 (填离子符号)。 (4)上述五种元素的最高价氧化物对应的水化物中酸性最强的是 (填化学式)。
|
|||||||||||||||||||
| 22. | 详细信息 |
|
A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水,D元素原子的次外层电子数比最外层电子数多4,E元素原子最外层与最内层电子数的差是3,试回答: (1)写出下列元素的元素符号:A ,C ,D ,E 。 (2)用电子式表示B和F形成化合物的 (3)写出A、C、F三种元素最高价氧化物对应的水化物相互反应的化学方程式: ; ;
。
|
|