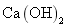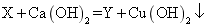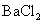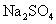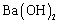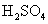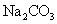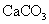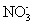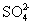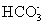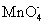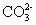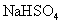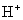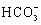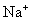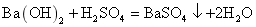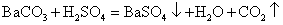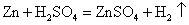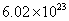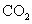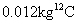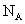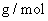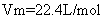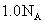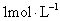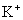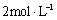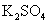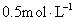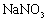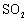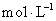宁夏省2021-2022学年高一上学期期中考试化学试题含解析
| 1. | 详细信息 |
|
既能跟稀硫酸反应又能跟熟石灰反应的物质是 ( ) A . 硫酸铜 B . 碳酸钠 C . 氢氧化钠 D . 碳酸钙 |
|
| 2. | 详细信息 |
|
下列有关雾的说法正确的是 A . 雾是溶液,能永久在空气中稳定存在 B . 雾是胶体,一段时间内能稳定存在 C . 雾是乳浊液,不能稳定存在 D . 雾是悬浊液,在空气中能沉降 |
|
| 3. | 详细信息 |
|
X 与 A . X 可能是酸 B . X 和 Y 相对分子质量之差为 24 C . X 可能是单质,也可能是化合物 D . Y 只可能是 |
|
| 4. | 详细信息 |
|
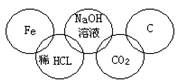
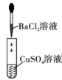
实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上,如下图,做 “ 硫酸的性质 ” 的实验时,某同学取用 BaCl 2 溶液后,应把它放回的位置是 A . A B . B C . C D . D |
|
| 5. | 详细信息 |
|
小美在奥运五连环中填入了 5 种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。你认为 “ 五连环 ” 中物质间发生的反应,没有涉及的基本反应类型是 A .复分解反应 B .分解反应 C .化合反应 D .置换反应 |
|
| 6. | 详细信息 |
|
下列属于电解质的是 A .蔗糖 B .盐酸 C .酒精 D .氢氧化钠 |
|
| 7. | 详细信息 |
|
下列物质在水溶液中的电离方程式错误的是( ) A . NaHCO 3 =Na + + H + + CO 3 2- B . NaHSO 4 =Na + + H + + SO 4 2- C . MgCl 2 =Mg 2+ + 2Cl - D . Ba(OH) 2 =Ba 2+ + 2OH - |
|
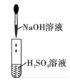
| 8. | 详细信息 | ||||||||||||
|
某同学在实验室中进行如下实验:
以下结论正确的是 A . I 中无明显变化,说明两溶液不反应 B . II 中的白色沉淀为 CuCl 2 C . III 中的离子方程式为 2H + +Zn=Zn 2+ +H 2 ↑ D . I 中发生的反应不是离子反应 |
|||||||||||||
| 9. | 详细信息 |
|
下列各项的两组物质在溶液中的反应,可用同一离子方程式表示的是 A . 氢氧化钠与盐酸;氢氧化钠与碳酸 B . C . D . 石灰石与硝酸;大理石与盐酸 |
|
| 10. | 详细信息 |
|
某溶液遇石蕊溶液显红色,下列各组离子能在该溶液中大量共存的是 A . Na + 、 C . Fe 2+ 、 |
|
| 11. | 详细信息 |
|
A . C . |
|
| 12. | 详细信息 |
|
能用离子方程式 “ A . B . C . D . |
|
| 13. | 详细信息 |
|
下列离子方程式不正确的是 ( ) A . 氢氧化钠与盐酸反应: OH - + H + =H 2 O B . 氧化镁与稀硫酸反应: O 2 - + 2H + =H 2 O C . 碳酸钡与盐酸反应: BaCO 3 + 2H + =Ba 2 + + H 2 O + CO 2 ↑ D . 食盐水中滴加硝酸银溶液: Cl - + Ag + =AgCl↓ |
|
| 14. | 详细信息 |
|
过滤后的食盐水仍含有可溶性的 CaCl 2 、 MgCl 2 、 Na 2 SO 4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水: ①加入稍过量的 Na 2 CO 3 溶液; ②加入稍过量的 NaOH 溶液; ③加入稍过量的 BaCl 2 溶液; ④滴入稀盐酸至无气泡产生:⑤过滤正确的操作顺序是 A . ③②①⑤④ B . ①②③⑤④ C . ②③①④⑤ D . ③⑤②①④ |
|
| 15. | 详细信息 |
|
下列叙述中正确的是 A . 摩尔是国际单位制中七个基本物理量之一 B . 2 mol 氧 C . 1 mol 粒子集体所含的粒子数约为 D . 1 mol |
|
| 16. | 详细信息 |
|
下列叙述中不正确的是 A . B . C . D . 1.7g 氨气中含有的电子数为 |
|
| 17. | 详细信息 |
|
某溶液中滴入 BaCl 2 溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中 A . 可能有 |
|
| 18. | 详细信息 |
|
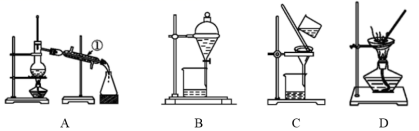
下列实验所选择的装置或操作正确的是( ) A . 用图 1 所示的装置可以实现用酒精提取溴水中的 Br 2 B . 用图 2 所示的装置分层时,两层液体先后从下口放出 C . 粗盐提纯,除去沉淀和泥沙等杂质时,选图 3 所示的装置 D . NaCl 溶液蒸发结晶时,选图 4 所示的装置,至蒸发皿中晶体全部析出时再停止加热 |
|
| 19. | 详细信息 |
|
用 N A 表示阿伏加德罗常数,下列叙述正确的是 A . 标准状况下, 22.4L H 2 O 含有的分子数为 1N A B . 常温常压下, 1.06g Na 2 CO 3 含有的 Na + 离子数为 0.02N A C . 通常状况下, 1N A 个 CO 2 分子占有的体积为 22.4L D . 物质的量浓度为 0.5mol/L 的 MgCl 2 溶液中,含有 Cl - 个数为 1N A |
|
| 20. | 详细信息 |
|
下列溶液中,溶质的物质的量浓度为 A . 含 B . 将 C . 将 40g NaOH 溶于 1L 水所得的溶液 D . 将 62g |
|
| 21. | 详细信息 |
|
现有 HCl 、 H 2 O 、 NH 3 三种物质,它们都含有 1mol 氢原子,则三种物质的物质的量之比为( ) A . 1∶1∶1 B . 6∶3∶2 C . 3∶2∶1 D . 1∶2∶3 |
|
| 22. | 详细信息 |
|
同温、同压下,等质量的 A . 密度之比为 16 : 11 B . 分子数之比为 16 : 11 C . 体积之比为 1 : 1 D . 物质的量之比为 16 : 11 |
|
| 23. | 详细信息 |
|
标准状况下, 0.112 L 某气体的质量为 0.17 g ,该气体可能是 A . HCl B . H 2 S C . Cl 2 D . O 2 |
|
| 24. | 详细信息 |
|
把 2.3g Na 投入 18g 水中,则溶液中水分子和 A . 1 : 10 B . 9 : 1 C . 10 : 1 D . 100 : 1 |
|
| 25. | 详细信息 |
|
标准状况下, 8 克由氢气和氮气组成的混合气体的体积是 44.8 升,混合气中氢气和氮气的质量比是 A . 6 : 7 B . 7 : 6 C . 12 : 1 D . 1 : 12 |
|
| 26. | 详细信息 |
|
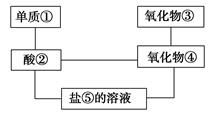
给下图中 ① ~ ⑤ 选择适当的物质,使有连线的两物质能发生反应。供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉。 (1) 请推断它们的化学式分别为 ① ________ ; ② ________ ; ③ ________ ; ④ ________ ; ⑤ ________ 。 (2) 写出下列序号之间的化学方程式: ① 和 ② : _____________________________________________________ ; ② 和 ④ : _____________________________________________________ ; ② 和 ⑤ : _____________________________________________________ ; ③ 和 ④ : ____________________________________________________ 。 |
|
| 27. | 详细信息 |
|
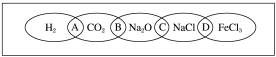
如图为一 “铁链”图案,小明在图案上分别写了 H 2 、 CO 2 、 Na 2 O 、 NaCl 、 FeCl 3 五种物质,图中相连的两种物质均可归属为一类,相交部分 A 、 B 、 C 、 D 为其相应的分类依据代号。请回答下列问题: ( 1 )请将分类依据代号填入相应的括号内。 ( ______ ) 两种物质都不是电解质 ( ______ ) 两种物质都是钠的化合物 ( ______ ) 两种物质都是氧化物 ( ______ ) 两种物质都是盐 ( 2 )用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的上图中某种物质 M 的溶液,继续加热至呈红褐色。 ①物质 M 的化学式为 ________ 。 ②证明有红褐色胶体生成的实验操作是 _________________________ 。 |
|
| 28. | 详细信息 |
|
如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: ( 1 ) 从氯化钾溶液中得到氯化钾固体,选择装置 ___________ ( 填代表装置图的字母,下同 ) ;除去自来水中的 ( 2 ) 从碘水中分离出 I 2 ,得到固体碘,选择装置 ___________ 、 ___________ 。分离方法的名称为 ___________ 、 ___________ 。 ( 3 ) 装置 A 中 ①的名称是 ___________ ,进水的方向是从 ___________ ( 填 “ 上 ” 或 “ 下 ”) 口进水。 ( 4 ) 装置 B 在分液时为使液体顺利流下,先进行的操作是 ___________ ,后再打开下端活塞 |
|
| 29. | 详细信息 |
|
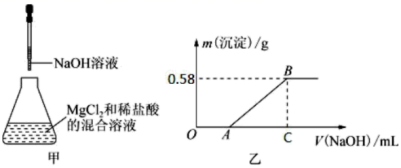
某同学称取一定质量的 请回答下列问题: ( 1 ) 溶解 a. 天平 b. 烧杯 c. 漏斗 d. 玻璃棒 ( 2 ) OA 段反应的离子方程式为 ___________ 。 ( 3 ) AB 段反应的离子方程式为 ___________ 。 ( 4 ) B 点的数值是 ___________ 。 |
|
| 30. | 详细信息 |
|
用 18 ①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解④转移、洗涤⑤定容、摇匀 完成下列问题: ( 1 ) 所需浓硫酸的体积是 ___________ ( 精确到小数点后一位 ) ,量取浓硫酸所用的量筒的规格是 ___________ ( 从下列规格中选用 ) A . 10mL B . 25mL C . 50mL D . 100mL) 。 ( 2 ) 第 ③步实验的操作是 ___________ 。 ( 3 ) 下列情况对所配制的稀硫酸浓度有何影响? ( 用 “偏大”“偏小”“无影响”填写 ) A .所用的浓硫酸长时间放置在密封不好的容器中 ___________ 。 B .容量瓶用蒸馏洗涤后残留有少量的水 ___________ 。 C .所用过的烧杯、玻璃棒未洗涤 ___________ 。 D .定容时俯视刻度线 ___________ 。 ( 4 ) 欲配制 240mL 0.100mol/L 的 NaOH 溶液,需要称量 ___________ g NaOH 固体,称量 NaOH 固体时,放在上烧杯中称量。 |
|