2020四川高二下学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
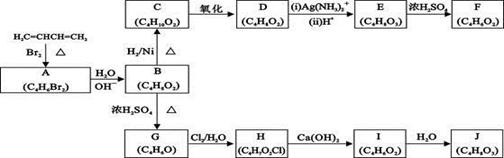
A~J均为有机化合物,它们之间的转化如下图所示:
已知: 1、D既能发生银镜反应,又能与金属钠反应放出氢气: 2、F是环状化合物,核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1; 3、G是环状化合物,能使溴的四氯化碳溶液褪色; 4、1mol J与足量金属钠反应可放出22.4L氢气(标准状况)。 请根据以上信息回答下列问题: (1)A的结构简式为 由A生成B的反应类型是 反应 (2)C转化为D的方程式为 。 (3)由E生成F的化学方程式为 。 H中的非含氧官能团有 (填名称),与E具有相同官能团的E的同分异构体还有 (任写一个,不考虑立体结构); (4)G的结构简式为 。
|
|
| 2. | 详细信息 | ||||||||||||
|
某原料经测定主要含有A、B、C、D、E五种原子序数依次增大的前四周期元素,其相关信息如下:
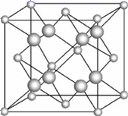
请回答下列问题(用A、B、C、D、E所对应的元素符号作答): (1) B、C、D第一电离能由大到小的顺序为_____。 (2) E的二价离子的电子排布式为_____。 (3) A2B2D4常用作除锈剂,该分子中B的杂化方式为_____;1 mol A2B2D4分子中含有σ键与π键的数目之比为_____。 (4) 与化合物BD互为等电子体的阴离子的化学式为_____(任写一种)。 (5) B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是___。 (6) 一种E和金(Au)形成的合金晶体具有面心立方最密堆积结构,其晶胞中E原子处于面心,Au原子处于顶点,则该合金中E原子与Au原子的个数之比为___;若相临两个Au原子的最短距离为a厘米,则该合金的密度为_____g/cm3。又知上述晶体具有储氢功能,氢原子可进入到由E原子与Au原子构成的四面体空隙中。若将E原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(见图)的结构相似,该晶体储氢后的化学式应为_____。
|
|||||||||||||
| 3. | 详细信息 |
|
物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡。根据所学知识回答下列问题: (1)下列方法中,可以使0.10 mol/L CH3COOH溶液中 a.加水稀释 b.加入少量CH3COONa固体c.加入少量冰醋酸 d.通入少量HCl气体 (2)t℃时,水的离子积常数Kw=1×10-12。 ①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则a+b= 。 ②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因 ;该混合溶液中:c(A-)-c(Na+)= mol/L。(填准确数值) (3)常温下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。 ①三种溶液pH由大到小的顺序为: (填序号)。 ②溶液a的pH大于8,则溶液中c(H2CO3) c(CO32-) (填“>”、“<”或“=”)。 (4)已知25℃ 时,Ksp[AgCl]=1.8×10-10,现将足量氯化银分别放入:a.100mL蒸馏水中;b.100mL 0.2 mol/LAgNO3溶液中;c.100mL 0.1 mol/L氯化铝溶液中;d.100mL 0.1 mol/L盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 。 (填写序号);b中氯离子的浓度为 mol/L。
|
|
| 4. | 详细信息 |
|
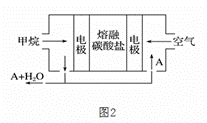
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如图1所示。
回答下列问题: (1)电解过程中,电解池阴极的电极反应式为______;控制电流,可使电解池阳极同时发生两个电极反应:其中一个为2H2O -4e- === O2↑+ 4H+,另一个电极反应式为______。 (2)电解池溶液中得到Fe(OH)3沉淀的离子方程式为______。 (3)某熔融盐燃料电池以熔融的多种碱金属碳酸盐混合物为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极,如图2。若该熔融盐燃料电池为电浮选凝聚法的电解电源,则:
①正极的电极反应式为______; ②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是______。 ③实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池理论上消耗CH4______L(标准状况)。
|
|
| 5. | 详细信息 | ||||||||||||
|
在生产生活中,酸碱中和及溶液酸碱性研究具有十分重要的意义。 (1)常温下,将2种一元酸分别和NaOH溶液等体积混合,实验数据如下:
①甲组实验中HY为_________(填强、弱)酸,0.1 moL/L HY溶液的pH=_____________。 ②乙组实验中发生反应的离子方程式为_________________________________。 ③乙组实验所得溶液中由水电离出的c(OH-)=________ mol/L。 (2)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL 0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如下图所示。
①滴定HCl溶液的曲线是___________(填“I”或“Ⅱ”); ②a=__________ mL。 ③c(Na+)=c(CH3COO-)的点是_____________。 ④E点对应离子浓度由大到小的顺序为_________________。 (3)将一定量某浓度的NaOH溶液,加入MgCO3悬浊液中,可以生成更难溶的Mg(OH)2。该反应的离子方程式为_____________________________。
|
|||||||||||||
| 6. | 详细信息 |
|
25 ℃时,某溶液中只含有Na+、H+、OH-、A-四种离子。下列说法正确的是( ) A.对于该溶液一定存在:pH≥7 B.在c(OH-)>c(H+)的溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+) C.若溶液中c(A-)=c(Na+),则溶液一定呈中性 D.若溶质为NaA,则溶液中一定存在: c(Na+)>c(A-)>c(OH-)>c(H+)
|
|
| 7. | 详细信息 |
|
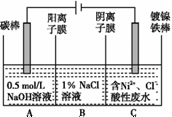
工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
已知:①Ni2+在弱酸性溶液中发生水解②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度) A.碳棒上发生的电极反应:4OH--4e- B.电解过程中,B室中NaCl溶液的物质的量浓度将不断减小 C.为了提高Ni的产率,电解过程中需要控制废水pH D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
|
|
| 8. | 详细信息 |
|
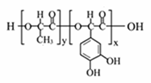
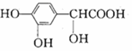
高聚物L:是一种来源于生物学灵感的新型粘合剂。下列关于高聚物L的说法中,不正确的是
A.单体之一为 C.
|
|
| 9. | 详细信息 |
|
核糖是合成核酸的重要原料,结构简式为CH2OH—CHOH—CHOH—CHOH—CHO。下列关于核糖的叙述正确的是 A.与葡萄糖互为同分异构体 B.跟氯化铁溶液作用显色 C.与银氨溶液作用形成银镜 D.可以使紫色石蕊溶液变红
|
|
| 10. | 详细信息 |
|
在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s) A.加MgCl2 B.加H2O C.加NaOH D.加HCl
|
|
| 11. | 详细信息 |
|
已知有机物a: A.苯是a的同分异构体 B.a中6个碳原子都在同一平面内 C.b可使溴水、酸性KMnO4溶液褪色,且反应类型相同 D.b的一氯代物有5种
|
|
| 12. | 详细信息 |
|
“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句。下列说法不正确的是 A.蚕丝的主要成分是蛋白质 B.蚕丝属于天然高分子材料 C.“蜡炬成灰”过程中发生了氧化反应 D.“泪”是油酯,属于高分子聚合物
|
|


 B
B



