2018高二上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列物质中,水解的最终产物含有葡萄糖的是( ) A.淀粉 B.乙酸乙酯 C.蛋白质 D.油脂
|
|
| 2. | 详细信息 |
|
下列物质不是天然高分子化合物的是( ) A. 淀粉 B. 纤维素 C. 蛋白质 D. 油脂
|
|
| 3. | 详细信息 |
|
下列物质中既有离子键又有共价键的是( ) A.氯化氢 B.乙醇 C.碘单质 D.氢氧化钠
|
|
| 4. | 详细信息 |
|
下列不属于三大合成材料的是( ) A. 塑料 B. 陶瓷 C. 合成纤维 D. 合成橡胶
|
|
| 5. | 详细信息 |
|
“嫦娥飞天、玉兔登月”,实现了中华民族“九天揽月”的伟大梦想。制造登月车太阳能电池板的半导体材料是( ) A.铝合金 B.二氧化硅 C.硅 D.铁合金
|
|
| 6. | 详细信息 |
|
下列分散系,能产生丁达尔效应的是 ( ) A. Na2S04溶液 B.Fe(OH)3胶体 C.FeCl3溶液 D.NaOH溶液
|
|
| 7. | 详细信息 |
|
盛有浓硫酸的烧杯敞口放置一段时间后,质量增加.是因为浓硫酸具有( ) A.吸水性 B.脱水性 C.强氧化性 D.酸性
|
|
| 8. | 详细信息 |
|
下列仪器中能用于直接加热的是 ( ) A.烧杯 B. 试管 C.量筒 D.圆底烧瓶
|
|
| 9. | 详细信息 |
|
天文科学家研究证明,组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是( ) A.20Ne和22Ne互为同位素 B.20Ne和22Ne的电子数不同 C.20Ne和22Ne的质量数相同 D.20Ne和22Ne的中子数相同
|
|
| 10. | 详细信息 |
|
在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是( ) A.制催化剂的材料 B.耐高温、耐腐蚀的合金材料 C.制农药的材料 D.半导体材料
|
|
| 11. | 详细信息 |
|
下列反应属于吸热反应的是 ( ) A.Al和稀盐酸反应 B.稀盐酸和NaOH溶液反应 C.煅烧石灰石 D.
|
|
| 12. | 详细信息 |
|
对下列实验事故处理的方法不正确的是( ) A.实验台上的酒精灯碰翻着火,立即用湿抹布扑灭 B.金属钠着火,用泡沫灭火器扑灭 C.发现人员一氧化碳中毒时,立即转移到通风的地方救治 D.厨房煤气泄漏,立即关闭阀门并开窗通风
|
|
| 13. | 详细信息 |
|
既能与盐酸反应又能与氢氧化钠溶液反应的化合物是( ) A.
|
|
| 14. | 详细信息 |
|
下列过程属于物理变化的是( ) A. C.活性炭使红墨水褪色 D.漂白粉使某些染料褪色
|
|
| 15. | 详细信息 |
|
在密闭容器中,合成氨的反应 后N2浓度为6mol/L,则用N2浓度变化表示的反应速率为( ) A.O.4mol/(L·min) B.0.2mol/(L·min) C.0.8mol/(L·min) D.1.2mol/(L·min)
|
|
| 16. | 详细信息 |
|
下列化学用语的书写不正确的是( )
C. 氮气的电子式:
|
|
| 17. | 详细信息 |
|
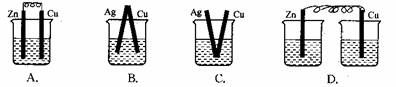
.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是( )
|
|
| 18. | 详细信息 |
|
下列各组离子中,能在溶液中大量共存的是( ) A. C.
|
|
| 19. | 详细信息 |
|
用NA表示阿伏加德罗常数,下列叙述正确的是( ) A.标准状况下,22.4LH2O含有的分子数为NA B.常温常压下,1.06gNa2C03含有的Na+数为0.02NA C.通常状况下,NA个C02分子占有的体积为22.4L D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
|
|
| 20. | 详细信息 |
|
.有氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液.只用一种试剂就能加以区别,这种试剂是() A.KSCN B.BaCl2 C.NaOH D.HCl
|
|
| 21. | 详细信息 |
|
氧化还原反应发生在同种元素之间的是 ( ) A.Zn+2HCl=ZnCl2+H2↑ B.2H2S+SO2=3S↓+2H2O C.H2+CuO
|
|
| 22. | 详细信息 |
|
用光洁的铂丝蘸取某无色溶液,在无色灯焰中灼烧时,观察到黄色火焰,下列有关叙述中正确的是( ) A.只有Na+ B.一定含Na+,也可能含K + C.既有Na+ 又有K+ D.可能含Na+,也可能含K +
|
|
| 23. | 详细信息 |
|
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),反应结果并不改变的是( ) A、Na和O2 B、NaOH和CO2 C、Na2O2和CO2 D、木炭(C)和O2
|
|
| 24. | 详细信息 |
|
将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,如Fe有剩余,则容器中只能有( ) A.Cu、Fe3+ B.Fe2+、Fe3+ C.Cu、Cu2+、Fe D.Cu、Fe2+、Fe
|
|
| 25. | 详细信息 |
|
下列离子方程式的书写不正确的是( ) A. 铁跟稀硫酸反应:Fe + 2H+ = Fe2+ + H2↑ B. 大理石和盐酸反应: CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ C. 醋酸跟氢氧化钾溶液反应: H+ + OH- = H2O D.MgCO3跟稀盐酸反应: MgCO3 + 2H+ = Mg2+ + H2O + CO2↑
|
|
| 26. | 详细信息 |
|
下表为元素周期表的一部分,请参照①~⑩在表中的位置,用化学用语回答下列问题:
(1)元素③形成的氢化物的电子式为_________;元素②形成的最高价氧化物的结构式为________。 (2)②、③、④、⑤元素形成的氢化物中,热稳定性最强的是 _________(填化学式),沸点最高的是__________(填化学式)。 (3)元素⑩在周期表中的位置_________; (4)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较__________(填化学式)。 (5)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为___________。 (6)用电子式表示⑥、⑧两元素结合成化合物的形成过程__________________。
|
|
| 27. | 详细信息 |
|
I (化学反应原理) (1)在101kPa时,足量H2在1mol O2中完全燃烧生成2mol液态水,放出571.6kJ的热量,H2的燃烧热△H=___________,表示H2燃烧热的热化学方程式为____________________。 (2) 1.00 L 1.00 mol·L-1硫酸与2.00 L 1.00 mol·L-1NaOH溶液完全反应,放出 114. 6 kJ的热量,该反应的中和热△H=_____________,表示其中和热的热化学方程式为_____________。 II(化学与生活) 某生活栏目向观众推荐一款美味主食——香酥牛肉饼,其部分原料如下: ① 面粉、② 牛肉、③ 食盐、④ 花生油。请回答: (1)富含淀粉的是 (填序号,下同)。(2)富含油脂的是 。 (3)富含蛋白质的是 。 (4)属于调味剂的是 。
|
|
| 28. | 详细信息 |
|
(1)25℃,100 mL氢氧化钡溶液中含有1×10-3 mol的OH-,该溶液的pH为 。 (2)常温下,CuCl2的水溶液呈 (填“酸”、“中”或“碱”)性,原因是 (用离子方程式表示)。 (3)把AlCl3溶液在空气中蒸干、灼烧,最后得到的主要固体产物是 。 (4)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液中 c(Na+) c(CH3COO-)(填“ >”、“=”或“<” )。 II(化学与生活) 有四种常见药物 ①阿司匹林 ②青霉素 ③胃舒平 ④麻黄碱.请回答: (1)某同学胃酸过多,应选用的药物是______(填序号),抗酸药是治疗胃酸过多的一类药品,请写出一种抗酸药(有效成分是碳酸钙)中和胃酸过多的化学反应方程式:________ ___。 (2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是 (填序号)。 (3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是_______(填序号)。 (4)滥用药物会导致不良后果,如过量服用________(填序号)会出现水杨酸中毒,应立即停药,并静脉注射___________。
|
|
| 29. | 详细信息 |
|
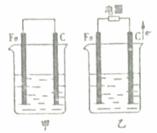
I(化学反应原理)
(1)甲池中铁作______极,乙池中铁作_______极。 (2)甲池中铁电极反应________________________, 碳电极反应_____________________ 。 (3)乙池中总反应化学方程式___________________。 II(化学与生活) 材料与生活、生产息息相关,目前使用的材料主要有:金属材料、传统无机非金属材料、新型无机非金属材料、高分子材料、复合材料等。 (1) 硅酸盐材料是重要的传统无机非金尾材料,也是日常生活、交通工具、建筑行业等不可缺少的材料之一。下列不属于硅酸盐产品的是 (填写序号) ①光导纤维 ②水泥 ③玻璃 ④陶瓷 (2)玻璃是重要的建筑和装饰材料,玻璃属于______(填“纯净物”或“混合物”)。有些玻璃的花纹是利用氢氟酸对普通玻璃中的二氧化硅的腐蚀作用而制成的,写出该反应的化学方程式 。 (3)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅,该反应属于化学反应基本类型中的_____反应;已知氮化硅中硅元素的化合价为+4价,则氮化硅的化学式为_________。
|
|
| 30. | 详细信息 |
|
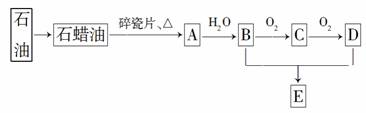
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有果香气味的烃的衍生物。A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
(已知乙醛在一定条件下可被氧化生成乙酸) (1)丁烷是由石蜡油获得A的过程中的中间产物之一,它的一种同分异构体中含有三个甲基,则这种同分异构体的结构简式为________。 (2)B、D分子中官能团的名称分别是________、________,A→B的反应类型是________。 (3)写出反应A→B 、B→C的化学方程式: _______________________________________________________________ 。
|
|
| 31. | 详细信息 |
|
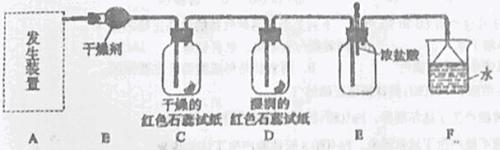
某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分挟持装置已略去)进行实验:
(1)写出实验室用固体制取氨气的化学方程式___________________________。 (2)利用上述原理,实验室制取氨气应选用下图中________发生装置进行实验。
(3)B装置中的干燥剂可选用________(填“碱石灰”或“浓硫酸”)。 (4)气体通过C、D装置时,试纸颜色会发生变化的是________(填“C”或“D”),试纸颜色变为___________。 (5)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,发生的化学反应是____________可观察到的现象是____________。 (6)F装置的作用是____________,装置中倒扣的漏斗是为了_____________________。
|
|
| 32. | 详细信息 |
|
实验室用铜与浓硫酸加热制取适量的SO2。现用100 mL的浓硫酸与铜片反应,标准状况下生成的SO2的体积为5.6 L,计算: (1)理论上参加反应的铜为多少g? (2)被还原的H2SO4的物质的量为多少mol? (要求写出计算过程)
|
|
| 33. | 详细信息 |
|
恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g) (1)从开始反应到平衡状态,生成C的平均反应速率为__________。 (2)x=_________,该反应的化学平衡表达式为________________。 (3)A的转化率与B的转化率之比为________。 (4)下列各项可作为该反应达到平衡状态的标志是_______ (填字母)。 A.压强不再变化 B.气体密度不再变化 C.气体平均相对分子质量不再变化 D. A的消耗速率与B的消耗速率之比为2:1 II (化学与生活) 保持营养平衡、科学使用食品添加剂并合理使用药物,有助于健康和提高人体自身免疫力. ①如图为某品牌鸡精标签的一部分,其中能水解生成氨基 酸的配料是________,属于着色剂的是_____,属于防腐剂的是____________。
②在一支盛有2mL2%淀粉溶液的试管中滴入2滴碘水.溶液呈蓝色,再滴入维生素C的水溶液,溶液颜色变化是__________,该实验说明维生素C具有___________性(选填:“酸”、“氧化”或“还原”)。
|
|