甘肃省武威市民勤县第一中学2020-2021年高二上半期12月月考化学题同步训练免费试卷
| 1. 选择题 | 详细信息 |
|
催化剂之所以能加快反应速率,是因为 A.减小了反应速率常数 B.降低了反应的活化能 C.降低了反应的焓 D.降低了反应的递熵 |
|
| 2. 选择题 | 详细信息 |
|
下列溶液一定呈中性的是 ) A. cOH)=cH+)的溶液 B. 盐溶液 C. pH=3的酸与pH=11的碱等体积混合所得溶液 D. pH=7的溶液 |
|
| 3. 选择题 | 详细信息 |
|
在0.1mol·L-1的CH3COOH溶液中,要促进醋酸电离且使H+浓度增大,应采取的措施是( ) A.升温 B.加水 C.加入NaOH溶液 D.加入稀盐酸 |
|
| 4. 选择题 | 详细信息 |
下列反应的能量变化符合图的是 A.CH4 燃烧 B.食物腐败变质 C.NaOH 溶液滴定 HCl 溶液 D.Ba(OH)2·8H2O与 NH4Cl 反应制冷 |
|
| 5. 选择题 | 详细信息 |
|
室温下,在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( ) ①K+、Cl-、NO ②K+、Fe2+、I-、SO ③Na+、Cl-、NO ④Na+、Ca2+、Cl-、HCO ⑤K+、Ba2+、Cl-、NO A.③⑤ B.①③⑤ C.①③ D.②④⑤ |
|
| 6. 选择题 | 详细信息 | ||||||||||||
室温下,次氯酸、碳酸和亚硫酸的电离常数
|
|||||||||||||
| 7. 选择题 | 详细信息 |
|
强酸与强碱的稀溶液反应的热化学方程式为H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,向1L0.5mol·L-1的NaOH溶液中加入下列物质:①稀醋酸、②浓硫酸、③稀硝酸,恰好完全反应的热效应分别为ΔH1、ΔH2、ΔH3,三者的关系正确的是( ) A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH3<ΔH2 C.ΔH1=ΔH3>ΔH2 D.ΔH1>ΔH3>ΔH2 |
|
| 8. 选择题 | 详细信息 |
|
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是 A. υ(W)=3υ(Z) B. 2υ(X)=3υ(Z) C. 2υ(X)="v(Y)" D. 3υ(W)=2υ(X) |
|
| 9. 选择题 | 详细信息 |
|
下列对于化学反应方向说法正确的是( ) A.反应2A(g)+B(g)=3C(s)+D(g)在一定条件下能自发进行,说明该反应的ΔH>0 B.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则ΔH<0 C.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)在一定条件下能自发进行,则该反应的ΔH>0 D.一定温度下,反应2NaCl(s)=2Na(s)+Cl2(g)的ΔH<0,ΔS>0 |
|
| 10. 选择题 | 详细信息 |
|
己知丙烷的燃烧热△H=-2215KJ·mol-1,若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为( ) A. 55 kJ B. 220 kJ C. 550 kJ D. 1108 kJ |
|
| 11. 选择题 | 详细信息 |
|
下列关于电离平衡常数(K)的说法中正确的是( ) A.电离平衡常数(K)越小,表示弱电解质电离能力越弱 B.电离平衡常数(K)与温度无关 C.相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同 D.多元弱酸各步电离平衡常数相互关系为K1<K2<K3 |
|
| 12. 选择题 | 详细信息 |
2mol 金属钠和 1mol 氯气反应的能量关系如图所示,下列说法不正确的是( ) A.∆H2<0 B.∆H4+∆H5+∆H8=∆H1 C.在相同条件下,2K(g)→2K+(g)的∆ D.∆H6+∆H7=∆H8 |
|
| 13. 选择题 | 详细信息 |
|
常温下,下列溶液中酸性最强的是( ) A.pH=3的盐酸溶液 B.c(H+)=5×10-5 mol/L的溶液 C.c(OH-)=1×10-12 mol/L的溶液 D.0.1 mol/L的盐酸溶液 |
|
| 14. 选择题 | 详细信息 |
常温下,向pOH[pOH=-lgc(OH-)均为2的NaOH与YOH溶液中分别加水稀释,溶液pOH随溶液体积变化的曲线如图所下列说法正确的是( ) A.水的电离程度:a<b B.稀释到pOH均为3时,加水量:V水(NaOH)<V水(YOH) C.稀释前NaOH与YOH的物质的量浓度均为0.01mol•L-1 D.无限稀释时,NaOH与YOH的pOH仍按图示比例一直增大 |
|
| 15. 选择题 | 详细信息 |
|
对室温下浓度、体积均相同的HCl溶液和CH3COOH溶液分别采取以下措施不正确的是( ) A.加足量的Zn充分反应时,在HCl溶液中的起始速率较快 B.加足量的Zn充分反应后,两溶液中产生的氢气一样多 C.使温度升高20℃,两溶液的氢离子浓度都不变 D.与等浓度的NaOH溶液反应,消耗NaOH溶液的体积一样多 |
|
| 16. 选择题 | 详细信息 |
用1.0mol·L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示。原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是 A.1mol·L-1,60mL B.0.5mol·L-1,80mL C.0.5mol·L-1,40mL D.1mol·L-1.80mL |
|
| 17. 填空题 | 详细信息 |
一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示: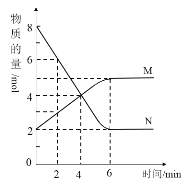 (1)反应的化学方程式为___。 (2)反应达到最大限度的时间是___min,该时间内的平均反应速率v(N)=__,v(M)=__。 (3)反应达到平衡状态时,放出6QkJ的热量,当容器中充入1molN,反应放出的热量为__。 ①等于QkJ ②小于QkJ ③大于QkJ ④等于2QkJ (4)判断该反应达到平衡状态的依据是__。 ①该条件下,正逆反应速率都为零 ②该条件下,混合气体的密度不再发生变化 ③该条件下,混合气体的压强不再发生变化 ④该条件下,单位时间内消耗2molN的同时,生成1molM (5)能加快反应速率的措施是___。 ①升高温度②容器体积不变,充入惰性气体Ar③容器压强不变,充入惰性气体Ar④使用催化剂 |
|
| 18. 填空题 | 详细信息 |
| 某温度下,纯水中的c(H+)=2×10-7mol·L-1,则此时c(OH-)为___;Kw为__若温度不变,滴入稀盐酸使c(H+)=5×10-4mol·L-1,则溶液中c(OH-)为___,由水电离产生的c(H+)为___,此时温度__(填“高于”、“低于”或“等于”)25℃。 | |
| 19. | 详细信息 | |||||||||||||||||||||||||
|
近年来我国大力加强温室气体 (1)已知: 写出 (2)为提高 a.高温高压 b.低温低压 c.高温低压 d.低温高压 (3)250℃时,在恒容密闭容器中由  时某反应物X的平衡转化率的变化曲线。 时某反应物X的平衡转化率的变化曲线。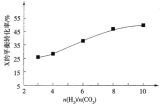 反应物X是___(填“ (4)250℃时,在体积为 ①前10min内 ②化学平衡常数 ③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
根据上表所给数据,用 |
||||||||||||||||||||||||||
| 20. 实验题 | 详细信息 | ||||||||||||||||||||||
|
现应用酸碱中和滴定法测定某市售白醋的含酸量. Ⅰ.实验步骤 (1)用___________(填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液. (2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_________作指示剂. (3)读取盛装0.1000 mol•L﹣1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如右图所示,则此时的读数为_______mL. (4)滴定.滴定过程中,眼睛应注视__________________________; 当滴至____________________________________时停止滴定,并记录NaOH溶液的终读数.重复滴定4次. Ⅱ.实验记录
|
|||||||||||||||||||||||
最近更新



