2018吉林高二上学期人教版高中化学期中考试
| 1. | 详细信息 |
|
以下属于新能源的主要包括( ) ①核能 ②柴草 ③焦炭 ④太阳能 ⑤氢能 ⑥液化石油气 ⑦水煤气 ⑧天然气 A.②③⑥⑦ B.①④⑤ C.③⑥⑦⑧ D.①②④
|
|
| 2. | 详细信息 |
|
下列物质放入水中,会显著放热的是( ) A.生石灰 B.蔗糖 C.酒精 D.食盐
|
|
| 3. | 详细信息 |
|
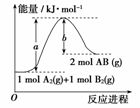
A.每生成2分子AB吸收b kJ热量 B.该反应中反应物的总能量高于生成物的总能量 C.该反应热ΔH=+(a-b) kJ·mol-1 D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
|
|
| 4. | 详细信息 |
|
对于反应3A(g)+B(g) A.v(A)=0.6mol/(L·min) B.v(B)=0.8 mol/(L·min) C.v(C)=0.7mol/(L·min) D.v(D)=1.0mol/(L·min)
|
|
| 5. | 详细信息 |
|
实验室测得4molSO2发生反应2SO2(g)+O2(g) 当放出314.3kJ热量时,SO2的转化率最接近于( ) A.40% B.50% C.80% D.90%
|
|
| 6. | 详细信息 |
|
实验测得101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ的热量;1mol CH4完全燃烧生成液态水和CO2气体,放出890.3kJ的热量。下列热化学方程式书写正确的是( ) A.2H2(g)+O2(g)=2H2O(l) ΔH=-285.8kJ·mol-1 B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1 C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890.3kJ·mol-1
|
|
| 7. | 详细信息 |
|
一定温度和压强不变的条件下,发生可逆反应:A(g)+3B(g) ①混合气体的平均摩尔质量不再变化 ②v (A)∶v(B)∶v(C)=1∶3∶4 ③A、B、C的浓度不再变化 ④C的体积分数不再变化 ⑤A、B、C的分子数之比为1∶3∶4 ⑥混合气体的密度不再变化 A.②③④⑤⑥ B.③④ C.②③④ D.①③⑤⑥
|
|
| 8. | 详细信息 |
|
下列叙述中,不能用勒夏特列原理解释的是( ) A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 B.合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率 C.过氧化氢分解加催化剂二氧化锰,使单位时间内产生的氧气的量增多 D.久置的氯水的pH变小
|
|
| 9. | 详细信息 |
|
下列说法中不正确的是( ) ①将AgCl固体放入水中不能导电,所以AgCl是非电解质 ②氨溶于水得到的溶液氨水能导电,所以氨水是电解质 ③固态的共价化合物不导电,熔融状态的共价化合物可以导电 ④固态的离子化合物不导电,熔融状态的离子化合物也不导电 ⑤强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强 A.⑤ B.①④⑤ C.①②③④ D.①②③④⑤
|
|
| 10. | 详细信息 |
|
25℃时,水的电离达到平衡:H2O A.向水中加入少量固体硫酸氢钠,c (H+)增大,Kw不变 B.向水中加入氨水,平衡逆向移动,c (OH-)降低 C.向水中加入金属钠,平衡逆向移动,c (H+)减小 D.将水加热,Kw增大,pH不变
|
|
| 11. | 详细信息 |
|
常温下,下列溶液中各组离子一定能大量共存的是( ) A.使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、Fe2+ B.由水电离产生的 c(H+)=10-12 mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl- C.含有 0.1 mol·L-1S2-的溶液:Na+、Fe3+、NO3-、Cl- D.Kw/c(H+)=0.1 mol·L-1的溶液:Na+、K+、SO32-、NO3-
|
|
| 12. | 详细信息 |
|
可逆反应mA(s)+nB(g)
A.达到平衡后,若使用催化剂,C的体积分数将增大 B.达到平衡后,若温度升高,化学平衡向逆反应方向移动 C.化学方程式中,n>e+f D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
|
|
| 13. | 详细信息 |
|
下列有关说法不正确的是( ) A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0 B.反应CaCO3(s)=CaO(s)+CO2(g)在室温下不能自发进行,说明该反应ΔH<0 C.一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH>0,ΔS>0 D.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0
|
|
| 14. | 详细信息 |
|
25 ℃时,将pH=2和pH=5的硫酸溶液等体积混合后,溶液的pH为( ) A.2.3 B.4.7 C.3.5 D.以上答案都不正确
|
|
| 15. | 详细信息 | ||||||||||
|
根据键能估算反应CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热ΔH为( )
A.–1940 kJ·mol-1 B.1940 kJ·mol-1 C.–485 kJ·mol-1 D.485 kJ·mol-1
|
|||||||||||
| 16. | 详细信息 |
|
25 ℃时,下列四种溶液中,由水电离生成的氢离子浓度之比是( ) ①1 mol·L-1的盐酸 ②0.1 mol·L-1的盐酸 ③0.01 mol·L-1的NaOH溶液 ④1 mol·L-1的NaOH溶液 A.1∶10∶100∶1 B.1∶10-1∶10-12∶10-14 C.14∶13∶12∶14 D.14∶13∶2∶1
|
|
| 17. | 详细信息 |
|
已知中和热的数值是57.3kJ·mol-1。下列物质反应时产生热量为57.3kJ的是( ) A.稀盐酸和稀NaOH溶液
|
|
| 18. | 详细信息 |
|
某温度下,密闭容器中发生反应aX(g) A.可逆反应的化学方程式中化学计量数:a>b+c B.压缩容器的容积时,v正增大,v逆减小 C.达到新平衡时,物质X的转化率减小 D.达到新平衡时,混合物中Z的质量分数增大
|
|
| 19. | 详细信息 | |||||||||||||||||||||||
|
某温度下在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g)
A.该反应的正向为吸热反应 B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小 C.容器I中反应达到平衡所需时间比容器Ⅲ中的长 D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
|
||||||||||||||||||||||||
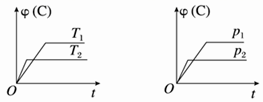
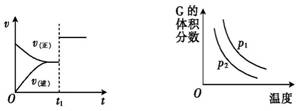
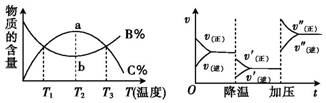
| 20. | 详细信息 |
|
根据相应的图像,判断下列相关说法正确的是( )
A.aX(g)+bY(g)
C.aA+bB A.t1时改变某一条件,如图所示,则改变的条件一定是加入催化剂 B.反应达到平衡时,外界条件对平衡的影响如图所示,则该反应为放热反应 C.从加反应物开始,物质的百分含量与温度的关系如图,则该反应为吸热反应 D.反应速率和反应条件的变化如图所示,则该反应为放热反应,若A、B、C是气体,则D为固体或液体
|
|
| 21. | 详细信息 |
|
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂的作用下转化为单质S。已知: ①CO(g)+0.5O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1 ②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1 则处理CO、SO2的方法的热化学方程式是________________________________。 (2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知: CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0) 2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0) 若用标准状况下3.36 L CO将NO2还原至N2(CO完全反应),则整个过程中转移电子的物质的量为______mol,放出的热量为_____(用含有a和b的代数式表示)kJ。 (3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如: CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ① CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2 ② 若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=_______。 (4)已知下列热化学方程式: ① ② 则H2的燃烧热(△H)为________________________
|
|
| 22. | 详细信息 |
|
请回答下列问题: (1)纯水在T ℃时,pH=6,该温度下1 mol·L-1的NaOH溶液中,由水电离出的c(OH-)=_______mol·L-1。 (2)某一元弱酸溶液(A)与二元强酸(B)的pH相等。若将两溶液稀释相同的倍数后,pH(A)___pH(B) (填“>”、“=”或“<”); 现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A) _____V(B)(填“>”、“=”或“<”)。 (3)25℃时,0.05mol/LH2SO4溶液的pH=_________; 0.05mol/LBa(OH)2溶液中的c(H+)=_______ (4)某温度下纯水中的c(H+)=2×10-7mol/L,则此时水中的c(OH-) = ;若温度不变,滴入稀盐酸,使c(H+)=5×10-4mol/L, 则溶液中c(OH-)= ,此时溶液中由水电离产生的c(H+)= 。
|
|
| 23. | 详细信息 | ||||||||||||||||||
|
某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。 (1)盛装0.2000 mol/L盐酸标准液应该用______式滴定管。(填“酸”或“碱”) (2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视________________。直到加入一滴盐酸后,溶液由_______________________________,即到终点。 (3)滴定操作可分解为如下几步: ①检查滴定管是否漏水;②取一定体积的待测液于锥形瓶中; ③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管; ④装标准溶液和待测液并调整液面(记录初读数); ⑤用蒸馏水洗涤玻璃仪器;⑥滴定操作 正确的操作顺序为:______________________。 (4)有关数据记录如下:
则NaOH溶液的物质的量浓度为______mol/L。 (5)若滴定时锥形瓶未干燥,则测定结果________;若滴定前平视读数,滴定终点时仰视读数,则所测碱的浓度值________。(填“无影响”、“偏高”或“偏低”)。
|
|||||||||||||||||||
| 24. | 详细信息 | ||||||||||||
|
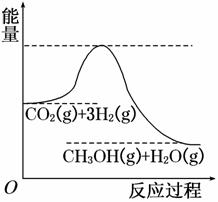
Ⅰ、由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应: CO2(g)+3H2(g)
(1)上述反应平衡常数K的表达式为________________,温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。 (2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=________。
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是________(填写序号字母) a.及时分离出CH3OH气体 b.适当升高温度 c.保持容器的容积不变,再充入1 mol CO2和3 mol H2 d.选择高效催化剂 Ⅱ、(1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,如图所示(T1、T2均大于300℃)
下列说法正确的是________(填序号); ①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)= mol·L-1·min-1 ②该反应在T1时的平衡常数比T2时的小 ③该反应为放热反应 ④处于A点的反应体系从T1变到T2,达到平衡时 (2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________。
|
|||||||||||||
 已知化学反应
已知化学反应