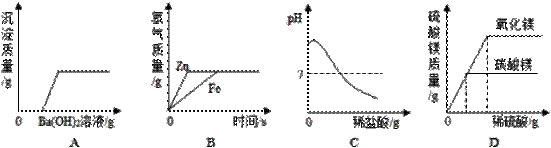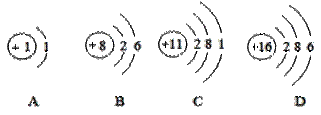四川省渠县九校2017届九年级化学下学期第二次联合模拟试题及答案
| 1. | 详细信息 |
|
下列变化与化学变化无关的是。( ) A.长期放置在空气中的铁质量增加。 B.实验室久置的过氧化氢溶液溶质质量分数降低。 C.敞口放置于空气中的氧化钙质量增加。 D.敞口放置于空气中的浓硫酸质量增加。
|
|
| 2. | 详细信息 |
|
普光气田位于四川省达州市宣汉县,国务院将“川气东送”工程列为“十一五”国家重大工程,将普光气田作为工程的主供气源。普光气田生产的天然气在送到最终用户之前,为助于泄漏检测,还要用四氢噻吩(C4H8S)等来给天然气添加气味。下列说法正确的是。( ) A.四氢噻吩是有机物。 B.天然气中加入四氢噻吩利用的是其化学性质。 C.四氢噻吩由碳氢硫原子构成。 D.四氢噻吩中氢元素质量分数最大。
|
|
| 3. | 详细信息 |
|
下列说法正确的是( ) A.用含碘食盐能使淀粉变蓝。 B.黄金搭档富含的钙铁锌硒均属于人体健康所需微量元素。 C.合成纤维、合成橡胶、塑料都是有机合成材料。 D.食用蔬菜水果能补充人体所需维生素D。
|
|
| 4. | 详细信息 |
|
学校花园的花草叶色发黄、易倒伏。据此,可以施用的化肥是( )。 A.KH2PO4 B.KNO3 C.CO(NH2)2 D.Ca3(PO4)2
|
|
| 5. | 详细信息 |
|
在已平衡的天平两边分别放一个等质量的烧杯,烧杯中装有等质量等溶质质量分数的足量稀盐酸,在左边烧杯中加入10g碳酸钙,要使天平再次保持平衡,在右边烧杯中加入下列物质及质量为( )。 A.6.4g 铜 B.4.4g铁 C.10g 碳酸氢钾固体 D.10g氢氧化钠固体
|
|
| 6. | 详细信息 |
|
下列图象能正确反映其对应操作中各量变化关系的是( )。 A. 向H2SO4和MgCl2的混合溶液中逐滴加入Ba(OH)2溶液至过量。 B.等质量的铁和锌跟足量的稀盐酸反应,产生氢气的质量与时间的关系。 C.向一定量的氢氧化钠溶液中逐滴加入稀盐酸至过量。 D.等质量的氧化镁和碳酸镁固体分别跟足量的稀硫酸反应。
|
|
| 7. | 详细信息 |
|
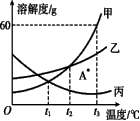
右图为甲、乙、丙三种物质的溶解度曲线。下列说法正确的是( )。
B.t3℃时甲的饱和溶液溶质质量分数是60%。 C.t3℃甲乙的饱和溶液降低温度到t2℃析出晶体由多到少的顺序为甲>乙。 D.A点表示是物质乙的饱和溶液。
|
|
| 8. | 详细信息 | ||||||||||||||||||||
|
除去下列物质中的杂质所用的试剂和方法不正确的是 ( )。
|
|||||||||||||||||||||
| 9. | 详细信息 |
|
用相应的化学用语填空。 (1)侯氏制“碱”中的“碱”_____________ 。 (2)生活中最常用的溶剂__________。 (3)生理盐水中的“盐”________________ 。 (4)2个铵根离子_____________。
|
|
| 10. | 详细信息 |
|
下图是各原子结构示意图,其中B与_______位于元素周期表中同一个族。AB两种元素的原子以比1:1比例形成的化合物的化学
|
|
| 11. | 详细信息 |
|
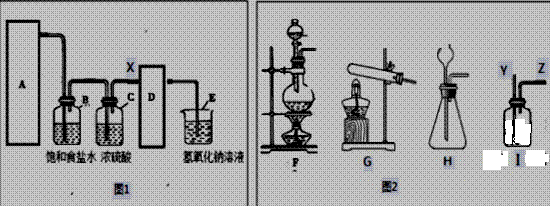
“十二五”期间,达州市共对37家排污单位进行立案调查,取缔部分畜禽养殖场,新建城市污水处理厂3个。 (1)水源地附近建立畜禽养殖场可能导致_________________________ 。 污水处理厂待处理污水发出阵阵恶臭,从微观角度分析能闻到阵阵恶臭的的主要原因 是_______。(填序号A.分子的质量很小 B.分子在不断运动着 D.分子间有间隔)可用 ____________________ 除去其臭味。 (2)污水处理厂工作人员测得待处理污水PH=6.3,该污水显_______(选填“酸性”“碱性”“中性”),可以向其中加入________________。 (3)污水处理中漂白粉可用水的杀菌消毒,其有效成分是次氯酸钙[化学式为Ca(ClO)2]。次氯酸钙可发生如下反应:Ca(ClO)2+X+H2O=CaCO3↓+2HClO,则X的化学式为_______ 。 (4)漂白粉的制取中需要用到氯气,实验室制氯气的原理:MnO2+4HCI(浓)
①图1是氯气的实验室制法装置图,请根据图2所提供仪器将图1补充完整:A 应该选择装置______ ,X处导管应该链接装置I的______端。 |
|
| 12. | 详细信息 |
|
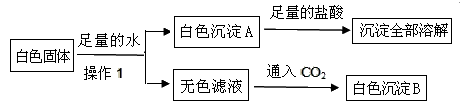
有一包白色粉末,可能是CuSO4、CaCO3、BaCl2、Na2SO4、NaOH、KNO3中的一种或几种,为证明其组成,进行如下实验: 根据上述实验现象判断: (3)写出通入CO2生成沉淀的化学方程式_____________________ ,_________________。
|
|
| 13. | 详细信息 |
|
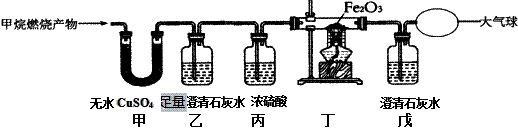
达州盛产天然气,有“中国气都”之称的美誉.天然气的主要成分是甲烷(CH4),我校化学兴趣小组的同学对甲烷燃烧的产物产生了兴趣,参与探究。 【提出问题】:甲烷燃烧后生成哪些物质? 【查阅资料】:含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO;无水CuSO4遇水变蓝。 【猜想与假设】: 猜想甲: CO2 H2O; 猜想乙: CO2 CO H2O; 猜想丙: ______________ 【实验探究】:为了验证上述猜想与假设,将甲烷在一定量的O2中燃烧的产物依次通过如图所示装置: (1)甲、乙装置的顺序能否颠倒?_______(填“能“或“否”) (2)实验中用纯净O2而不用空气的原因是 _____________________ 。 (3)实验中观察到甲中无水CuSO4变蓝,乙、戊中澄清石灰水变浑浊,丁中红色粉末变成黑色,由此推断_______ 同学猜想成立。 (4)装置乙的作用是___________________________,写出丁中发生的化学反应化学方程式:________________________ 。 【反思与交流】:为避免有毒的CO污染环境,所以含碳元素的物质燃烧必须满足的条件是 __________________________。 实验结束,对相关装置进行称量(忽略空气成分对实验的干扰):甲装置增重3.6g,乙装置增重2.2g。那么燃烧甲烷的质量为 _____ g,并写出该实验中甲烷燃烧的化学方程式 __________________________________________。
|
|
| 14. | 详细信息 | ||||||||||||
|
在实验室中甲乙两位同学分别进行了如下实验,其中甲观察到固体全部消失有气泡冒出,甲同学实验中发生的反应类型是___________,乙同学实验中观察到的现象是___________。反应结 【问题】:反应后大烧杯中上层清液中中含有哪些溶质? 【猜想】:①可能只含有:NaCl ②可能含有CaCl2、NaCl ③可能含有CaCl2、NaCl 和 Na2CO3 ④ 可能含有、NaCl 、Na2CO3 。 甲乙两位同学通过讨论一致认为上述猜想_____ 一定不成立,理由是__________________________。 【实验】:
|
|||||||||||||
| 15. | 详细信息 | ||||||||||||||||||
|
达州市钢铁厂用于炼铁的铁矿石主要主要成分是菱铁矿[FeCO3],课外小组同学取来该铁矿石样品12.5g,粉碎后,将125g一定溶质质量分数的稀盐酸分5次加入到该样品中,所测数据如下(杂质不与稀盐酸反应,也不溶于水):
(1)第_____次恰好完全反应 (2)该23200t这样的铁矿石理论上能冶炼得到铁的质量为_______。 (3)求加入稀盐酸恰好完全反应时所得溶液的溶质质量分数?(结果保留到0.1%)
|
|||||||||||||||||||