2019安徽高一下学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
在任何原子里都具有的粒子是( ) A、质子、中子、电子 B、质子、中子 C、质子、电子 D、中子、电子
|
|
| 2. | 详细信息 |
|
下列各分子中所有原子都满足最外层为8电子结构的是( ) A. BF3 B. CCl4 C. SCl6 D. HCl
|
|
| 3. | 详细信息 |
|
下列表示物质或微粒的化学用语或模型正确的是( ) A.CSO的电子式: C.CO2的分子示意图:
|
|
| 4. | 详细信息 |
|
1999年曾报导合成和分离了含高能量的正离子N5+ 的化合物N5AsF6,下列说法正确的是( ) A.其中只含有共价键,是共价化合物 B.其中只含有离子键,是离子化合物 C.其中既有离子键,又有共价键,是离子化合物 D.以上说法都不对
|
|
| 5. | 详细信息 |
|
下列化合物中阴离子半径和阳离子半径之比最大的是 ( ) A.LiI B.NaCl C.MgCl2 D.CaF2
|
|
| 6. | 详细信息 |
|
第五周期某主族元素的原子,它的最外电子层上有两个电子,下列关于此元素的叙述正确的是( ) A.原于半径比铷的原子半径大 B.氯化物难溶于水 C.金属性比镁弱 D.碳酸盐难溶于水
|
|
| 7. | 详细信息 |
|
短周期元素X、Y、Z、W在元素周期表中的相对位置如右下图所示,其中W原子的最高化合价与最低化合价代数和为2 ,下列说法不正确的是( )
B.最高价氧化物对应水化物的酸性:X>W>Z C.最简单气态氢化物的热稳定性:Y>X>W>Z D.元素X、Z、W的最高化合价分别与其主族序数相等
|
|
| 8. | 详细信息 |
|
金属冶炼一般有下列四种方法:①焦炭法 ②水煤气(或H2、CO)法 ③活泼金属置换法④电解法。这四种方法在工业上均有应用。古代有:(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析,不正确的是 ( ) A.(Ⅰ),① B.(Ⅱ),② C.(Ⅲ),③ D.(Ⅳ),④
|
|
| 9. | 详细信息 |
|
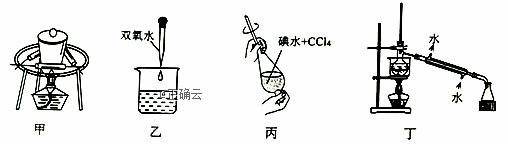
图甲~丁中关于海带提取碘的部分实验操作及目的正确的是( )
A.装置甲的作用是使海带中I2升华 B.装置乙加H2O2发生置换反应生成I2 C.装置丙用于富集水溶液中的I2 D.装置丁用于分离I2和水的混合物
|
|
| 10. | 详细信息 |
|
下列有关物质结构的说法正确的是( ) A.共价化合物中各原子最外层都一定满足8电子结构 B.BaO2晶体中阳离子与阴离子数目之比为1∶2 C.H2O是一种非常稳定的化合物,这是由于氢键所致 D.在反应2Na2O2+2H2O===4NaOH+O2↑中,既有离子键、极性键和非极性键的断裂,又有离子键、极性键和非极性键的形成
|
|
| 11. | 详细信息 |
|
下列事实与氢键有关的是:( ) A.水加热到很高的温度都难以分解 B.水结成冰时体积膨胀,密度减小 C.CH4、SiH4、GeH4沸点随相对分子质量增大而升高 D.HF、HCl、HBr、HI的热稳定性依次减弱
|
|
| 12. | 详细信息 |
|
某元素形成气态氢化物的分子式为HnR,其最高价氧化物对应水化物分子式中有m个氧原子,则其最高价氧化物对应水化物化学式为( )
|
|
| 13. | 详细信息 | |||
|
某元素的一种核素X的质量数为A,含N个中子,它与35Cl原子组成XClm分子,则a g XClm中所含质子的物质的量是( )
|
||||
| 14. | 详细信息 |
|
下列有关叙述:能说明元素M比N的非金属性强的是( ) ①非金属单质M能从N的化合物中置换出非金属单质N。 ②M原子比N原子更容易得到电子。 ③单质M跟H2反应比N跟H2反应容易得多。 ④气态氢化物水溶液的酸性HmM>HnN。 ⑤氧化物对应水化物的酸性HmMOx>HnNOy。 A.①②③⑤ B.②⑤ C.①②③ D. ①②④⑤
|
|
| 15. | 详细信息 |
|
下列各组物质中,化学键类型都相同的是( ) A. HCl与NaOH B. H2S与MgS C. H2O和CO2 D. H2SO4和NaNO3
|
|
| 16. | 详细信息 |
|
以下有关原子结构及元素周期律的叙述正确的是( ) A.第IA族元素铯的两种同位素137Cs比133Cs多4个质子 B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 C.第 ⅦA元素从上到下,其氢化物的稳定性逐渐增强 D.同主族元素从上到下,单质的熔点逐渐降低
|
|
| 17. | 详细信息 |
|
根据元素周期表和元素周期律,判断下列叙述不正确的是( ) A.气态氢化物的稳定性:H2O>NH3>SiH4 B.氢元素与其他元素可形成共价化合物或离子化合物 C.如右图所示实验可证明元素的非金属性:Cl>C>Si D.第118号元素在周期表中位于第七周期0族
|
|
| 18. | 详细信息 | ||
|
X | Y | ||
| Z | W | ||
| 19. | 详细信息 |
|
原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。M元素与X同主族,与W同周期。 (1) Z、W形成的气态氢化物的稳定性为 > ,(填化学式) 写出下列元素的名称:X_______、W_______, Z、M、W三种元素离子半径由大到小的顺序是 _________ (填相应的离子符号)。 (2) 由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,写出该反应的化学反应方程式 , 若有19.2g铜参加反应则会生成标准状况下气体体积为 。 (3) 用电子式表示M2W的形成过程_____________________________________________ (4) 由M、Z两元素形成的原子个数比为1∶1化合物的电子式为__________________ , 化学键类型是__________________ (5) 由X、Y、Z、W四种元素组成的一种盐A,已知: ①1molA能与足量NaOH浓溶液反应生成标准状况下22.4L气体。②A能与盐酸反应产生气体B,该气体能与溴水反应。写出A的化学式 , 该气体B与溴水反应的离子方程式 。
|
|
| 20. | 详细信息 |
|
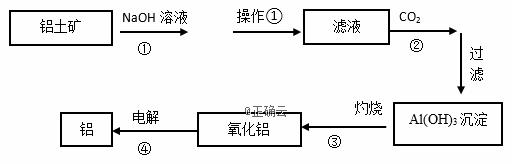
下图是工业上铝土矿(含有Al2O3和Fe2O3等)冶炼铝的工艺流程图:
(1)操作①的名称是:_________。操作①剩余的矿渣主要成分为:__________(填化学式)。 (2)图中①的离子方程式__________________________________________________; ④的化学反应方程式______________________________________________________。 (3)洗涤Al(OH)3沉淀的具体操作是: ________________________________________。
|
|
| 21. | 详细信息 |
|
下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案。 向新制的Na2S溶液中滴加新制的氯水 设计该实验方案的目的是:探究同周期元素的性质递变规律。
|
|