2017吉林高一下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
下列关于氨的叙述中,错误的是( ) A. 氨易液化,因此可用作制冷剂 B. 氨易溶解于水,因此可用来做喷泉实验 C. 氨极易溶解于水,因此氨水比较稳定(不容易分解) D. 氨溶解于水显弱碱性,因此可使酚酞试剂变为红色
|
|
| 2. | 详细信息 |
|
下列对于硝酸的认识,不正确的是( ) A. 浓硝酸和稀硝酸都具有氧化性 B. 铜和硝酸的反应属于置换反应 C. 浓硝酸在常温见光或受热时会分解 D. 常温下可用铁或铝制品盛装浓硝酸
|
|
| 3. | 详细信息 |
|
取3张蓝色石蕊试纸放在玻璃上,然后按顺序分别滴加浓硝酸、浓硫酸、新制的氯水,3张试纸最后呈现的颜色是( ) A. 白、红、 白 B. 红、黑、红 C. 红、红、白 D. 白、黑、白
|
|
| 4. | 详细信息 |
|
主族元素在周期表中的位置取决于该元素原子的( ) A. 相对原子质量和核外电子数 B. 电子层数和最外层电子数 C. 相对原子质量和最外层电子数 D. 电子层数和次外层电子数
|
|
| 5. | 详细信息 |
|
某元素的原子最外电子层上只有两个电子,该元素( ) A. 一定是金属元素 B. 一定是第ⅡA族元素 C. 一定是过渡元素 D. 可能是金属元素,也可能不是金属元素
|
|
| 6. | 详细信息 |
|
下列说法错误的是( ) A. 碱金属元素最外层电子数都是1个,化学性质均活泼 B. 碱金属元素从上到下随电子层数的增多金属性依次增强 C. 碱金属元素的单质都是银白色的,都比较柔软 D. 碱金属元素的单质从上到下熔沸点逐渐降低
|
|
| 7. | 详细信息 |
|
根据元素周期律判断,下列递变规律不正确的是( ) A. Cl Br I的非金属性依次减弱 B. HClO4 H2SO4 H3PO4 的酸性依次减弱 C. HCl HBr HI的稳定性依次增强 D. Cl2 Br2 I2 与H2反应的剧烈程度依次减弱
|
|
| 8. | 详细信息 |
|
下列化学用语表示正确的是( ) A. 原子核中有6个中子的硼原子:6B B. HCl的电子式:H+ [:Cl:]— C. HClO的结构式:H—O—Cl D. K+ 结构示意图:
|
|
| 9. | 详细信息 |
|
下列ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的法正确的是( ) A. 20Ne和22Ne互为同位素 B. 20Ne和22Ne互为同素异形体 C. 20Ne和22Ne的质量数相同 D. 20Ne和22Ne中子数相同
|
|
| 10. | 详细信息 |
|
M元素的一个原子失去2个电子,这2个电子转移到Y元素的2个原子中去,形成离子化合物Z,下列说法中,正确的是( ) A. Z的熔点较低 B. Z可表示为M2Y C. M离子和Y离子的核外电子排布相同 D. M形成+2价阳离子
|
|
| 11. | 详细信息 |
|
下列不属于离子化合物的是( ) A. Na2O2 B. CaF2 C. SO2 D. Ba(OH)2
|
|
| 12. | 详细信息 |
|
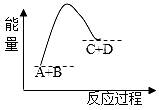
已知反应A(g)+B(g)=C(g)+D(s)的能量变化如图所示,下列说法正确的是( )
A. 该反应的能量变化表现为释放能量 B. 该反应中反应物A、B的总能量小于生成物C 的能量 C. 该反应的能量变化是将化学能转化为热能、电能等其它形式 D. 该反应能量变化的实质是旧化学键断裂和新化学键形成的结果
|
|
| 13. | 详细信息 |
|
下列有关化学反应与能量的说法正确的是( ) A. 燃烧属于放热反应 B. 中和反应是吸热反应 C. 形成化学键时吸收热量 D. 反应物总能量与生成物总能量一定相等
|
|
| 14. | 详细信息 |
|
下列实验现象描述错误的是( ) A. 铜置于浓硫酸中加热,最后可能有灰白色固体生成 B. 蔗糖与浓硫酸混合后,不断用玻璃棒搅拌,有刺激性气体产生 C. 在某未知试液中加入浓NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,则原未知试液中一定含有NH4+ D. 在某未知试液中滴加盐酸产生无色气体,将该气体通入足量澄清石灰水中得到白色沉淀,则原未知试液中一定含有CO32―
|
|
| 15. | 详细信息 |
|
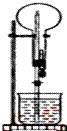
如图的装置中,干燥烧瓶中盛有某种气体,烧瓶和滴管内盛放某种液体,挤压胶管的胶头,下列与实验事实不相符的是( )
A. CO2(NaHCO3溶液)无色喷泉 B. NH3(H2O含酚酞)红色喷泉 C. H2S(CuSO4溶液)黑色喷泉 D. HCl(AgNO3溶液)白色喷泉
|
|
| 16. | 详细信息 |
|
下列叙述正确的是( ) A. 浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体 B. 浓硫酸与单质碳反应的化学方程式为:C+2H2SO4(浓) C. 把足量铜粉投入到含H2SO4 2 mol的浓硫酸中,得到气体体积标准状况下为22.4 L D. 常温下能够用铁、铝等容器盛放浓硫酸,是因为浓硫酸的强氧化性使其钝化
|
|
| 17. | 详细信息 |
|
某周期的第ⅠA族元素的原子序数为x,那么同一周期第ⅢA族元素的原子序数为( ) A. 肯定是x+2 B. 肯定是x+2或x+8或x+32 C. 肯定是x+2或x+12或x+26 D. 肯定是x+2或x+10或x+26
|
|
| 18. | 详细信息 |
|
已知1g氢气完全燃烧,生成气态水时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1molH—O键形成时放出热量463kJ,则氢气中1molH—H键断裂时吸收热量为( ) A. 920kJ B. 557kJ C. 436kJ D. 618kJ
|
|
| 19. | 详细信息 |
|
以下反应:①木炭与水制备水煤气,②氯酸钾分解,③炸药爆炸,④酸与碱的中和反应,⑤生石灰与水作用制熟石灰,⑥Ba(OH)2·8H2O 与NH4Cl,属于放热反应_________(填序号),写出反应⑥的化学方程式
|
|
| 20. | 详细信息 |
|
在下列化合物中:H2O2、Na2O、I2、NaCl、CO2、NH4Cl、Na2O2,用化学式回答下列问题: ①只由非金属组成的离子化合物是_________________; ②只有极性共价键的共价化合物是_________________; ③只含有非极性共价键的是_____________________; ④既有离子键又有非极性键的化合物是________________________。
|
|
| 21. | 详细信息 |
|
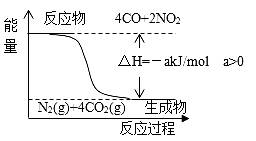
研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。 (1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。 已知:用CO(g)还原NO2(g)的能量转化关系如图所示。
若用标准状况下 22.4LCO,还原NO2至N2(CO完全反应)的整个过程中,转移电子的物质的量为_______mol,放出的热量为_______kJ(用含有a的代数式表示)。 (2)用CH4催化还原NOx也可以消除氮氧化物的污染。例如: ①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1 ②CH4(g)+4NO (g)=2N2(g)+CO2(g)+2H2O(g) △H2 若1molCH4还原NO2至N2和液态水,整个过程中放出的热量为867kJ,则△H2=______。
|
|
| 22. | 详细信息 | |||||||||||||||||||||||||||||||||||||||||||||
|
下表为元素周期表的一部分,请回答有关问题:
(1)表中最活泼的金属是________,非金属性最强的元素是________(填元素符号); (2)⑦的氢氧化物与⑥的最高价氧化物的水化物反应的化学方程式: _____________________________________________________。 (3)⑧⑨两种元素形成的化合物的最高价含氧酸的酸性强弱顺序是⑧_____⑨。 (4)①③两种元素形成的化合物的水溶液显_____(填“酸”、“中”或“碱”)性。 (5)④⑧两种元素所形成的气态氢化物中较不稳定的是___________(用化学式表示)
|
||||||||||||||||||||||||||||||||||||||||||||||
| 23. | 详细信息 | ||||||||||
|
现有部分元素的性质与原子(或分子)结构如图:
(1)画出元素T的原子结构示意图___________。 (2)元素Y与元素Z相比,金属性较强的是_________(用元素符号表示),下列表述中 能证明这一事实的是_________(填序号)。 A、Y单质的熔点比Z单质低 B、Y的化合价比Z低 C、Y单质与水反应比Z单质剧烈 D、Y的最高价氧化物的水化物的碱性比Z强 (3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性键的化合物,写出该化合物的化学式____________。 (4)元素T和氢元素以原子个数比1:1化合物形成的化合物的电子式______________。
|
|||||||||||
| 24. | 详细信息 |
|
某化学实验小组同学利用一下装置制备氨气,并探究氨气的性质(部分仪器已略去)
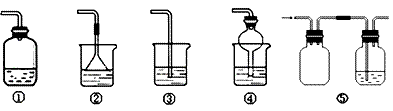
请回答: (1)实验室制备氨气的化学方程式为__________________________________________________; 干燥氨气常用的干燥剂是_______________。 (2)收集氨气时,请你选择氨气的进气口_________(填“a”或“b”), 理由是________________________________________________________________。 (3)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是_______;________________________________。 (4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是____________________(填序号)。
(5)氨气在催化剂并且加热时会被空气氧化,这是工业制硝酸的第一步反应,写出该反应的化学方程式___________________________________________________。
|
|
- 江苏省南京市第十二中学2020-2021年高二前半期第一次学情调研测试化学在线考试题免费练习
- 学军中学高三化学高考模拟(2019年下半年)试卷带解析及答案
- 2019-2020年高二上册9月月考化学免费试卷完整版(吉林省东辽五中)
- 鲁科版选择性必修1第1章 化学反应与能量转化 专题2 电极反应式的书写
- 2018年至2019年高一上半年第一次月考化学题开卷有益(河北省香河县第三中学)
- 2019年高三年级上半期期末考试化学题开卷有益(河南省天一大联考)
- 2018至2019年高一下半年期中考试化学免费试卷完整版(青海省大通回族土族自治县第一完全中学)
- 2017届新疆乌鲁木齐地区高三第二次诊断性测验化学专题训练