2017吉林高二下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
下列各组混合物中.能用分液漏斗分离的是( ) A. 酒精和水 B. 水和汽油 C. 汽油和四氯化碳 D. 醋酸和水
|
|
| 2. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法不正确的是( ) A. 9.2g NO2和N2O4的混合物中含氮原子数目为0.2NA B. 常温常压下,35.5g Cl2与足量的NaOH溶液完全反应,转移的电子数为0.5NA C. 标准状况下,2.24L NH3与1.6g CH4分子中所含电子数目均为NA D. 已知反应N2(g)+3H2(g)
|
|
| 3. | 详细信息 |
|
设NA表示阿伏加得罗常数,下列叙述正确的是( ) A. 标准状况下,1mol氦气所含的原子数为2NA B. 1.8g NH4+离子中所含的电子数为1.1NA C. 常温常压下,44g二氧化碳分子中所形成的共用电子对数为4NA D. NA个氮分子和NA个氢分子的体积相同
|
|
| 4. | 详细信息 |
|
下列各组离子,在所给的条件下一定能够大量共存的是( ) A. 在pH=0的溶液中:Fe2+、Mg2+、SO42-、Cl- B. 由水电离出的c(H+)=1×10—12mol/L的溶液中:NH4+、K+、Na+、NO3一 C. 在A1C13溶液中:SO32-、Na+、CO32-、AlO2- D. 在滴加石蕊试液后呈红色的溶液中:I一、Na+、S2-、AlO2-
|
|
| 5. | 详细信息 |
|
需配制一种仅含四种离子(不包括水电离出的离子)的无色混合溶液,且混合溶液中四种离子的物质的量浓度均为l mol/L。下面四个选项中能达到此目的的是( ) A. Na+、K+、NO3—、Cl- B. Cu2+、K+、SO42—、NO3— C. H+、K+、HCO3—、Cl- D. Mg2+、Na+、OH-、SO42—
|
|
| 6. | 详细信息 |
|
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O还原剂与还原产物物质的量之比为( ) A. 1:8 B. 8:1 C. 1:5 D. 5:1
|
|
| 7. | 详细信息 |
|
下列离子方程式书写正确的是( ) A. 向FeCl2溶液中通入Cl2:2Fe2++Cl2═2Fe3++2Cl﹣ B. Ba(OH)2溶液与硫酸反应:OH﹣+H+═H2O C. 次氯酸钙溶液中通入少量SO2:2ClO﹣+Ca2++SO2+H2O═CaSO3↓+2HClO D. 碳酸氢钠溶液中加入过量石灰水:2HCO3﹣+Ca2++2OH﹣═CaCO3↓+2H2O+ CO32-
|
|
| 8. | 详细信息 |
|
下列离子方程式中,错误的是( ) A. 钠和冷水反应:2Na+2H2O═2Na++2OH﹣+H2↑ B. AlCl3溶液中加入足量的氨水:Al3++4OH﹣═AlO2﹣+2H2O C. 将氯气通入水中:Cl2+H2O=Cl﹣+HClO+H+ D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3﹣═3Fe3++NO↑+2H2O
|
|
| 9. | 详细信息 |
|
常温下,下列各组离子在指定溶液中一定能大量共存的是( ) A. 使石蕊变红色的溶液: K+、Fe2+、SO42-、NO3- B. 0.1 mol·L-1NaHCO3溶液:K+、Ba2+、CO32-、Cl- C. c(OH-)/c(H+)= l0-12的溶液:K+、Al3+、Cl-、Br- D. 由水电离出的c(H+)= l0-12mol·L-1的溶液:Mg2+、K+、Br-、NO3-
|
|
| 10. | 详细信息 |
|
已知反应式:①H2S+I2=S↓+2H++2I﹣②H2SO3+2H2S=3S↓+3H2O ③2I﹣+Br2=I2+2Br﹣④H2SO3+I2+H2O=SO42﹣+2I﹣+4H+,下列各组中还原性由弱到强的是( ) A. H2S、H2SO3、I﹣、Br﹣ B. I﹣、Br﹣、H2SO3、H2S C. Br﹣、I﹣、H2SO3、H2S D. I﹣、Br﹣、H2S、H2SO3
|
|
| 11. | 详细信息 |
|
下列叙述中正确的是 ( ) A. B. 浓硫酸的脱水性属物理性质,相应的变化过程是物理变化 C. 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了漂白性 D. 氯气能使湿润的淀粉碘化钾试纸变蓝
|
|
| 12. | 详细信息 |
|
已知元素X的基态原子最外层电子排布为nsn-1npn+3,则X元素的原子序数为( ) A. 9 B. 10 C. 17 D. 18
|
|
| 13. | 详细信息 |
|
下列共价化合物中,共价键的键能最小的是( ) A. HCl B. HF C. HBr D. HI
|
|
| 14. | 详细信息 |
|
乙烯分子中碳原子的杂化类型为( ) A. sp杂化 B. sp2杂化 C. sp3杂化 D. 都不是
|
|
| 15. | 详细信息 |
|
下列物质的分子中,键角最大的是( ) A. H2O B. BF3 C. CH4 D. NH3
|
|
| 16. | 详细信息 |
|
下列事实,不能用氢键知识解释的是 ( ) A. 水比硫化氢稳定 B. 水和乙醇可以完全互溶 C. 冰的密度比液态水的密度小 D. 氟化氢的沸点高于氯化氢
|
|
| 17. | 详细信息 |
|
某原子晶体的基本结构单元是正二十面体,每个原子与另外五个原子相连,每个面均是正三角形,请分析该晶体的棱数和定点数( ) A. 60、12 B. 12、30 C. 30、12 D. 10、30
|
|
| 18. | 详细信息 |
|
下列既有离子键又有共价键的化合物是( ) A. NaCl B. Na2O C. CaF2 D. Na2O2
|
|
| 19. | 详细信息 |
|
硼及硼的化合物有着广泛的用途。请回答下列问题: (1)硼在元素周期表中的位置为____________________,电子排布式是________,硼元素有两种天然同位素10B和11B,硼元素的近似相对原子质量为10.8,则两种同位素原子的原子个数之比为__________。 (2)单质硼(B)在一定条件下与NaOH溶液反应生成NaBO2和一种气体,请写出该反应的化学方程式______________________________。 (3)硼酸(H3BO3)是一种白色片状晶体,微溶于水,对人体的受伤组织有着和缓的防腐消毒作用。硼酸是一元弱酸,室温时0.1mol/L硼酸的pH为5,计算硼酸的电离常数K=__________。氟硼酸(HBF4)是一种强酸,仅以离子状态存在于水中,请写出BF4﹣的电子式__________。 (4)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。 ①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构__________(填“相同”或“不相同”)。 ②B2H6可由BF3与NaBH4在一定条件下反应制得,写出该反应的化学方程式__________。 ③B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为__________L。
|
|
| 20. | 详细信息 | ||||||||
|
H、C、N、O、F、Na、Mn是常见的六种元素。 (1)N位于元素周期表第____周期第___族;Mn的基态原子核外电子排布式为___________;C2H4分子中σ键与π键数目之比为____________。 (2)用“>”或“<”填空:
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应: 氧化反应:H2O2-2e-===2H++O2↑ 还原反应:MnO4—+5e-+8H+===Mn2++4H2O 反应中还原剂是________;被还原的元素是________;若有2 molH2O2参加此反应,电子转移个数为________。
|
|||||||||
| 21. | 详细信息 |
|
(1)同温同压下的两个相同容器中分别装有N0和NO2气体,则两瓶气体中,原子数之比是______,质量之比是______,密度之比是______,分子数之比是___________。 (2)下列所给出的几组物质中:含有分子数最少的是_______;含有原子数最多的是________;标准状况下体积最小的是________。 ① 1gH2; ② 2.408×1023个CH4;③ 10.8gH2O; ④ 标准状况下6.72LCO2 (3)设NA表示阿伏加德罗常数,如果X g某气体含有的分子数是Y,则Z g该气体在标准状况下的体积是_______(用含NA的式子表示)。 (4)配制500 mL 0.1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的浓H2SO4(密度为1.84g/cm3)的体积为_______。
|
|
| 22. | 详细信息 |
|
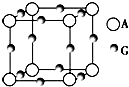
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(kJ·mol﹣1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q. (1)B的单质晶体为体心立方堆积模型,其配位数为_____;E元素的最高价氧化物分子的立体构型是______.F元素原子的价电子排布图是_____,G的高价离子与A的简单氢化物形成的配离子的化学式为_____. (2)试比较B、D分别与F形成的化合物的熔点高低并说明理由__________. (3)A、G形成某种化合物的晶胞结构如图所示.若阿伏加德罗常数为NA,该化合物晶体的密度为ag·cm﹣3,其晶胞的边长为_____ cm.
(4)在1.01×105 Pa、T1℃时,气体摩尔体积为53.4L·mol﹣1, 实验测得Q的气态密度为5.00g·L﹣1,则此时Q的组成为__________.
|
|
| 23. | 详细信息 |
|
元素及其化合物的应用研究是目前科学研究的前沿之一。试回答下列问题: (1)原子序数小于36的过渡元素A和B,在周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子。请写出A 在基态时的外围电子排布式为___________。 (2)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。水分子中心原子价层电子对数为_______,苯分子中碳原子的杂化类型为________。 (3)Co3+有多种配合物,如Co(CN)63-、Co(NH3)4Cl2+ 等。铑(Rh)与钴属于同族元素,某些性质相似。现有铑的某盐组成为CsRh(SO4)2·4H2O,易溶解于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成。该盐中铑离子的配位数为____。
|
|