2017湖北高三下学期人教版高中化学高考模拟
| 1. | 详细信息 |
|
下列有关化学与生产、生活的说法中,正确的是 A.碳纤维、合成纤维和光导纤维都是无机非金属材料 B.锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 C.使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力增强 D.铝合金的大量使用归功于人们能使用焦炭从氧化铝中获得铝
|
|
| 2. | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列有关叙述正确的是 A.在12.0 g NaHSO4晶体中,所含离子数目为0.3NA B.在1.0 L 1.0 mol/L的NaA1O2溶液中,含有的氧原子数为2NA c.将1molCl2通入足量水中,转移电子数为NA D.常温常压下,2.2 g CO2和N2O的混合气体含有的电子数为1. 1NA
|
|
| 3. | 详细信息 |
|
下列有机物的说法,正确的是 A.分子式为C5H12的有机物有三种,它们互为同系物 B. C4H8C12有9种同分异构体(不考虑立体异构) C.石蜡油、苯、四氟乙烯都不能使溴水褪色 D.等物质的量的甲烷与氯气反应后体积保持不变
|
|
| 4. | 详细信息 | |||||||||||||||||||||
|
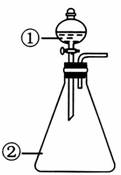
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象和结论合理的是
|
||||||||||||||||||||||
| 5. | 详细信息 | ||||||||||||
|
下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为Y元素的2倍。下列说法正确的是
A.元素X、W、Z在自然界中均可以游离态存在 B.元素X、Y、W的原子半径依次递增 C.实验室储存T的单质时,应在其表面覆盖少量的水 D.元素Z的氧化物是制作计算机芯片的材料
|
|||||||||||||
| 6. | 详细信息 |
|
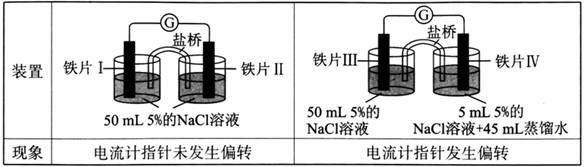
某同学做了如下实验:
下列说法中正确的是 A.加热铁片I所在烧杯,电流表指针会发生偏转 B.用KSCN溶液检验铁片Ⅲ、IV附近溶液,可判断电池的正、负极 C.铁片I、Ⅲ的腐蚀速率相等 D.“电流计指针未发生偏转”,说明铁片I、铁片Ⅱ均未被腐蚀
|
|
| 7. | 详细信息 |
|
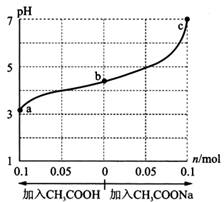
在25℃时,将 1.0 L wmoI/L CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。 下列叙述正确的是
A. a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b B.b点混合液中 c(Na+) >c(CH3COO-) C.加入CH3COOH过程中, D.25℃时,CH3COOH的电离平衡常数Ka=
|
|
| 8. | 详细信息 | ||||||||||||
|
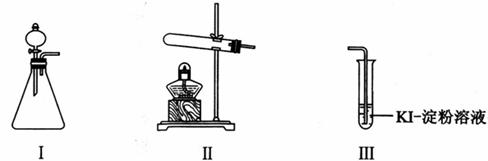
某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体 (1)小组同学设计甲、乙、丙三组实验,记录如下:
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。 (3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。 (4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。 A.酸性 KMnO4 B. FeCl2 C. Na2S D.品红 (5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)________________________造成的,请设计实验证明他们的猜想是否正确________________________________________________。
|
|||||||||||||
| 9. | 详细信息 |
|
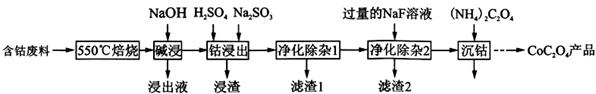
草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下::
(1)“550℃焙烧”的目的是______________________; (2)“浸出液”的主要成分是_____________________; (3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_____________________; (4) “净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是___________________________(用离子方程式表示);再升温至80 ~ 85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是 _____________________。 (5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-5mol /L,则滤液中 c(Mg2+)为________________ [已知Ksp(MgF2) =7.35×10-11、Ksp(CaF2) =1.05×10-10]。 (6)为测定制得样品的纯度,现称取1.00 g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0. 1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________。
|
|
| 10. | 详细信息 |
|
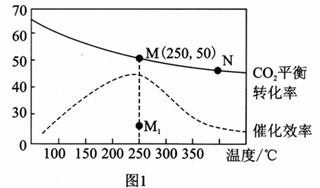
科学家积极探索新技术对CO2进行综合利用。 I. CO2可用来合成低碳烯烃。 2CO2(g) +6H2(g) 请回答: (1)已知:H2和CH2 =CH2的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g) (2)上述由CO2合成CH2 =CH2的反应在__________下自发进行(填“高温”或“低温”),理由是___________________。 (3)在体积为1 L的密闭容器中,充入3 mol H2和1 mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。下列说法正确的是_________。
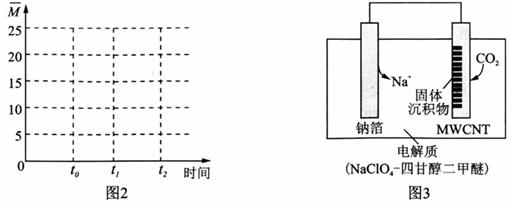
A.平衡常数大小:KM>KN B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1 C.图1中M点时,乙烯的体积分数为7.7% D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态 (4)保持温度不变,在体积为VL的恒容容器中以n(H2)∶n(CO2) = 3∶1的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达平衡。请在图2中作出容器内混合气体的平均相对分子质量
II .利用“ Na—CO2”电池将CO2变废为宝。 我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 (5)放电时,正极的电极反应式为______________________。 (6)若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为_________g。 (7)选用髙氯酸钠—四甘醇二甲醚做电解液的优点是___________________________(至少写两点)。
|
|
| 11. | 详细信息 | ||||||||
|
第二代半导体材料——(Ⅲ-V)A族化合物的特殊性能使之成为科学家的研究热点之一。 (1) 基态镓原子的价电子轨道表示式为_____________。 (2) N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,N2O的空间构型为_________,NH4NO3中N的杂化方式为_________________,与PO43-互为等电子体的分子有________________(填一种即可)。 (3)已知NH3分子的键角约为107°,而PH3分子的键角约为94°,试用价层电子对互斥理论解释NH3的键角比PH¥的键角大的原因__________________________。 (4)第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素有________________。 (5)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
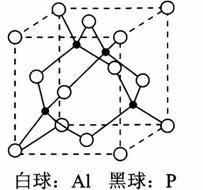
试从结构的角度分析它们熔点不同的原因_____________________。 (6)磷化铝晶胞如图所示,A1原子的配位数为________,若两个铝原子之间的最近距离为d pm,NA代表阿伏加德罗常数的值, 则磷化铝晶体的密度ρ=_________g/cm3。
白球:A1黑球:P
|
|||||||||
| 12. | 详细信息 |
|
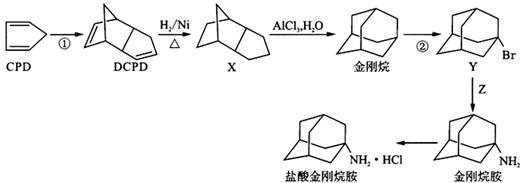
盐酸金刚烷胺是一种治疗和预防病毒性感染的药物,可用于抑制病毒穿入宿主细胞,从结构上看是一种对称的三环状胺,可以利用环戊二烯(CPD)来制备合成,流程图如下:
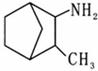
(1)下列关于X和金刚烷说法正确的是 A.金刚烷和X互为同分异构体,均可以发生氧化反应和取代反应 B.金刚烷和X均可以使溴水褪色 C.金刚烷和X均具有与芳香烃相似的化学性质 D.金刚烷和X均不存在手性碳原子 (2)反应①的反应类型为____________,反应②的条件为________________。 (3)有机物Y的一氯代物的同分异构体的数目为___________,写出Y与氢氧化钠的乙醇溶液反应的化学方程式___________________________________。 (4)有机物Z是一种重要的有机氮肥,在核磁共振氢谱谱图中只有一个峰,写出Z与浓硫酸反应的化学方程式___________________________________。 (5)CPD可以与Br2的CC14溶液反应,写出其所有可能产物的结构简式_______________。 (6)参照上述流程图,并用流程图中出现的试剂和 设计其合成路线。
|
|