2016河南高三下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列基态原子或离子的电子排布式错误的是 A.K 1s22s22p63s23p64s1 B.Mg2+ 1s22s22p6 C.F- 1s22s22p5 D.Br 1s22s22p63s23p63d104s24p5
|
|
| 2. | 详细信息 |
|
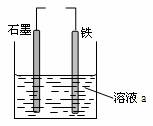
有关下图装置的说法中正确的是
A.若两电极直接连接,a是食盐水,则发生析氢腐蚀 B.若铁接电源负极,石墨接电源正极,a是稀H2SO4溶液,电解一段时间后溶液的pH增大 C.若两电极直接连接,则电子从铁流向石墨 D.若铁接电源正极,石墨接电源负极,a是氯化铜溶液,阴离子向石墨电极移动
|
|
| 3. | 详细信息 |
|
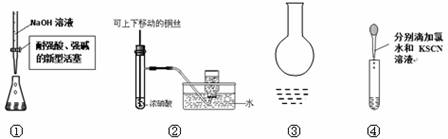
用下列装置能达到有关实验目的是
A.用①量取15.00 mL NaOH溶液 B.用②制备并收集少量NO2气体 C.用③所示的仪器配制1L 0.1000mol/LNaCl溶液 D.用④进行Fe2+的检验
|
|
| 4. | 详细信息 |
|
下列各组物质,按化合物、单质、混合物顺序排列的是( ) A.烧碱、液态氧、碘酒 B.生石灰、白磷、熟石灰 C.干冰、铁、氯化氢 D.空气、氮气、胆矾
|
|
| 5. | 详细信息 |
|
在100 mL 12 mol/L的浓盐酸中加入足量的MnO2加热,充分反应后得到Cl2的物质的量是(不考虑Cl2在反应过程中的任何损失) ( ) A.0.6 mol B.在0.3~0.6 mol之间 C.0.3 mol D.小于0.3 mol
|
|
| 6. | 详细信息 |
|
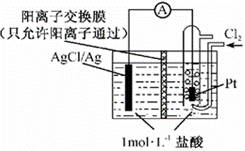
某原电池装置如右图,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
A.正极反应为AgCl +e-=Ag +Cl- B.放电时,交换膜右侧溶液中有大量白色沉淀生成 C.若用NaCl溶液代替盐酸,则电池总反应随之改变 D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
|
|
| 7. | 详细信息 |
|
下列关于短周期元素说法正确的是( ) ①均为主族元素,除稀有气体外,最高化合价与其族序数相等 ②元素所形成的单质可能是金属晶体、分子晶体、离子晶体或原子晶体 ③元素的氢化物水溶液可能显酸性,也可显碱性 ④元素气态氢化物的沸点随相对分子质量增大而增大 A.①②③④均不正确 B.只有①②③正确 C.只有③④正确 D.只有③正确
|
|
| 8. | 详细信息 |
|
有四种晶体,其离子排列方式如下图所示,其中化学式不属AB型的是( )
|
|
| 9. | 详细信息 |
|
培养明矾晶体,为使晶体颗粒结得大一些,不应采取的方法是 A.用比室温约高10~20℃的水溶解明矾晶体得到饱和溶液 B.使明矾饱和溶液急速冷却 C.选用形状较为规则的小明矾晶体作晶核 D.结晶过程中,应将硬纸板盖住盛有饱和溶液的烧杯
|
|
| 10. | 详细信息 |
|
能用H++OH-=H2O来表示的化学反应是 A.氢氧化镁和稀盐酸反应 B.Ba(OH)2溶液滴入稀硫酸中 C.澄清石灰水和稀硝酸反应 D.二氧化碳通入澄清石灰水中
|
|
| 11. | 详细信息 |
|
如图是表示:2X (g)+Y (g)
A.减少Z物质 B.加大压强 C.升高温度 D.使用催化剂
|
|
| 12. | 详细信息 |
|
下列关于硫酸性质的描述中,正确的是 A.浓H2SO4有氧化性,稀H2SO4无氧化性 B.由于浓H2SO4具有吸水性,故可用来与蔗糖反应做“黑面包”实验 C.稀H2SO4与铁、铝反应,浓H2SO4在常温下不与铁、铝反应 D.浓硫酸与Cu的反应中有少量黑色固体生成,可能是CuO
|
|
| 13. | 详细信息 |
|
下列叙述中正确的是( )。 A.淀粉、纤维素互为同分异构体,都属于糖类;硝酸纤维、醋酸纤维都属于酯类 B.骨胶、皮胶以及日常生活中常用的糨糊、胶水都是黏合剂 C.相对分子质量相同、组成元素也相同,但分子结构不同、性质也不同的两种有机物一定是同分异构体 D.由一个有机物分子在一定条件下反应,生成一个新的有机物分子和一个无机物分子的反应一定是消去反应
|
|
| 14. | 详细信息 |
|
下列实验中金属或金属氧化物可以完全溶解的是 A.常温下将64g铜片投入过量浓盐酸中 B.向100.0mL 3.00mol/L的稀硝酸中加入5.6g铁 C.1 mol MnO2粉末与含4molHCl的浓盐酸共热 D.常温下1 mol铝片投入20.0mL 18.40mol/L硫酸中
|
|
| 15. | 详细信息 |
|
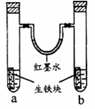
下图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
A.生铁块中的碳是原电池的正极 B.红墨水柱两边的液面变为左低右高 C.两试管中相同的电极反应式是:Fe-2e-=Fe2+ D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
|
|
| 16. | 详细信息 |
|
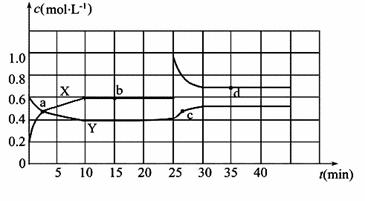
Ⅰ.在一定条件下,xA+yB (1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向___ ___移动。 (2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为___ ___。 Ⅱ.已知NO2和N2O4可以相互转化:2NO2(g)
(1)图中共有两条曲线X和Y,其中曲线_______表示NO2浓度随时间的变化;a、b、c、d四个点中, 表示化学反应处于平衡状态的点是__________。 (2)①前10 min内用NO2表示的化学反应速率v(NO2)=_______mol·L-1·min-1。 ②0~15 min ,反应2NO2(g) ③25 min~35 min时,反应2NO2(g) (3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_________(用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是_________。 A.加入催化剂 B.缩小容器体积 C.升高温度 D.加入一定量的N2O4
|
|
| 17. | 详细信息 | ||||||||||||||||||||
|
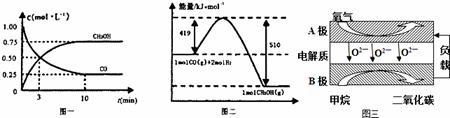
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法. I.已知反应Fe2O3(s)+3CO(g) (1)CO的平衡转化率= (2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是 a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2 e.粉碎矿石,使其与平衡混合气体充分接触 Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇: CO(g)+2H2(g)
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= (2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
则下列关系正确的是( ) A.c1=c2 B.2Q1=Q3 C.2α1=α3 D.α1+α2=1 Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图三是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题: (1)B极上的电极反应式为 (2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标况下).
|
|||||||||||||||||||||
| 18. | 详细信息 |
|
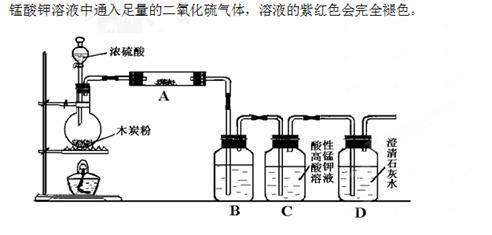
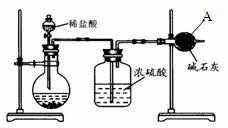
利用下图装置进行木炭粉和浓硫酸的反应及其产物的检验。 已知:紫红色的酸性高锰酸钾溶液能与二氧化硫发生氧化还原反应,向酸性高 (1)组装好上述装置后,首先要进行的操作是: 。 (2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式: 。 (3)用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入试剂的名称及其作用:A中加入的试剂和作用是 、 ;B中加入的试剂和作用是 、 。 (4)实验时,C中应观察到什么现象,才可以说明生成了二氧化碳: 。
|
|
| 19. | 详细信息 |
|
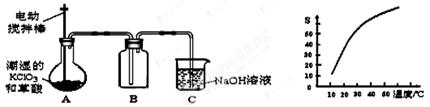
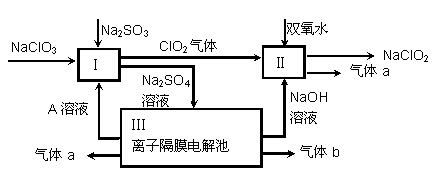
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示的装置模拟制取并收集ClO2。
(1)B必须放在冰水浴中控制温度,其原因是 。 (2)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a ;b ;③洗涤;④干燥。 (3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
① Ⅱ中反应的离子方程式是 。 ② ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式 。 ③ NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量 。(填“相同”,“不同”或“无法判断”)
|
|
| 20. | 详细信息 |
|
为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题。(相对原子质量:C=12 O=16 Ca=40) 【方案Ⅰ】如图:
①称取碳酸钙样品m g; ②加入过量盐酸; ③测定仪器A的增重为a g。 (1)仪器A的名称是____________。 【方案Ⅱ】 ①称取碳酸钙样品5.0 g; ②用1.00 mol/L盐酸100.0 mL(过量)溶解样品; ③取溶解后溶液体积的1/10 用0.1000mol/L NaOH溶液滴定,重复滴定三次,平均用去15.00mL。 (2)该碳酸钙样品的纯度= 。(计算结果保留三位有效数字) 【方案Ⅲ】 ①称取碳酸钙样品mg; ②高温煅烧1000 ℃直至质量不再改变,冷却后称量,固体质量为m’g。 (3)本方案中的“冷却”应在干燥器中进行,理由是 。 【方案Ⅳ】 ①称量碳酸钙样品m g; ②加入足量c mol/L盐酸V mL使之完全溶解; ③过滤并取滤液; ④在滤液中加入过量c ’mol/LNa2CO3溶液V’ mL; ⑤将步骤④中的沉淀滤出、洗涤、干燥、称重为b g。 (4)此方案中不需要的数据是(填字母序号) 。 A.m B.c、V C.c’、V’ D.b (5)综上所述,你认为四个方案中,最好的方案是 。写出其它一个方案的缺点:(如:方案Ⅳ;沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差。) 方案 ; 。
|
|
| 21. | 详细信息 |
|
有A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是Cl-、NO3-、SO42-、CO32-中的某一种(每种离子只能用一次)。 ①若将四种盐分别溶于水中,只有C盐的溶液呈蓝色。 ②若向四种盐溶液中分别加入盐酸,B盐溶液有沉淀生成,D盐溶液有无色无味气体逸出。 依据实验事实推断: A、B、C、D的化学式分别是_________、__________、___________、_________。
|
|
| 22. | 详细信息 |
|
将含Ca元素质量为20克的CaCl2固体溶于一定量水中形成溶液的体积为500mL,求CaCl2及Cl-的物质的量浓度。
|
|
| 23. | 详细信息 |
|
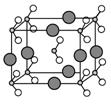
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。 (1)F原子基态的外围核外电子排布式为 。 (2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。 (3)元素B的简单气态氢化物的沸点 (高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 。 (4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。 (5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。 (6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因 。
|
|
| 24. | 详细信息 |
|
有A、B、C、D、E五种单核微粒:①当A微粒失去3个电子后,电子层结构与氖原子的相同;②B微粒得到一个电子后,其电子层结构与氩原子相同;③C微粒带两个单位正电荷,核电荷数为12;④D微粒18个电子。带两个单位的负电荷;⑤E微粒不带电,原子核中只有一个质子。请回答: (1)写出各微粒的符号:A_______、B_______、C_______、D_______、E_______。 (2)B微粒的结构示意图是_______,D微粒的结构示意图是_______。
|
|