2017高一下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
下列表示不正确的是( ) A. KOH的电子式: C. CH4的球棍模型:
|
|
| 2. | 详细信息 |
|
将纯铁片和纯铜片按下图所示插入同浓度的稀硫酸中一段时间,下列叙述正确的是
A. 甲装置中电能转化为化学能 B. 两个装置中铜片表面均有气泡产生 C. 甲装置中H+移向铜片 D. 甲中负极上发生的电极反应为Fe-3e-=Fe3+
|
|
| 3. | 详细信息 | |||||||||||||||
|
下列实验“操作和现象”与“结论”对应关系正确的是( )
A. A B. B C. C D. D
|
||||||||||||||||
| 4. | 详细信息 |
|
地球上氦元素主要以4He存在,而月球上土壤中吸附着数百万吨3He,据估算3He核聚变所释放的能量可供人类使用上万年。下列说法正确的是:( ) ①3He、4He的化学性质基本相同; ②3He、4He具有相同的中子数; ③3He核聚变是化学变化; ④3He液化是物理变化 A. ①② B. ①④ C. ②③ D. ③④
|
|
| 5. | 详细信息 |
|
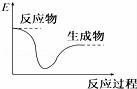
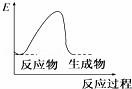
各图中表示热化学方程式A(g)+B(g)═C(g)+D(l)△H<0的是(E表示能量)( ) A C.
|
|
| 6. | 详细信息 |
|
下列有关晶体的说法中正确的是 A. 氯化钾溶于水时离子键未被破坏 B. 原子晶体中共价键越强,熔点越高 C. 晶体中有阳离子必含阴离子 D. 分子间作用力越大,分子越稳定
|
|
| 7. | 详细信息 |
|
下列图示实验合理的是
A. 图1为证明S、C、Si元素的非金属性强弱的装置 B. 图2为可随开随停制备少量氧气的装置 C. 图3为配制100mL一定浓度硫酸溶液 D. 图4制备并收集少量NO2气体
|
|
| 8. | 详细信息 |
|
下列关于元素周期表的叙述中正确的是 A. 除零族元素外,短周期元素 B. 元素周期表共七个横行代表七个周期,18 个纵行代表18 个族 C. 主、副族元素的 D. 除零族外,由长、短周期元素共同组成的元素族称为主族
|
|
| 9. | 详细信息 |
|
下列属于吸热反应的是
A. A B. B C. C D. D
|
|
| 10. | 详细信息 |
|
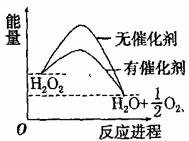
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示。下列说法正确的是
A. 反应物的总能量高于生成物的总能量 B. 加入催化剂,可提高H2O2的平衡转化率 C. H2O2分解的热化学方程式:H2O2=H2O+1/2O2 △H>0 D. 加入催化剂,减小了反应的热效应
|
|
| 11. | 详细信息 |
|
下列说法正确的是 A. 含有共价健的化合物一定是共价化合物 B. 在共价化合物中一定含有共价键 C. 离子化合物中只含有离子键 D. 有化学键断裂的变化一定是化学变化
|
|
| 12. | 详细信息 |
|
下列化学用语正确的是( ) A. 硫原子结构示意图: B. 乙烯分子的结构式:CH2===CH2 C. H2O2的电子式:H+[ D. 碳酸氢钠的电离方程式NaHCO3=Na++HCO3-
|
|
| 13. | 详细信息 |
|
下列微粒半径之比大于1的是 ( ) A. r (P) / r (Si) B. r (Be) / r (Mg) C. r(K) / r(Na) D. r(Cl) / r(Cl)
|
|
| 14. | 详细信息 |
|
目前常见的燃料电池主要有四种,下面是这四种燃料电池的工作原
A. A B. B C. C D. D
|
|
| 15. | 详细信息 |
|
a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是( ) A. d元素的非金属性最强 B. 它们均存在两种或两种以上的氧化物 C. 只有a与题中其他元素生成的化合物都是离子化合物 D. c、d形成的气态氢化物的还原性:d>c
|
|
| 16. | 详细信息 |
|
某元素最高价氧化物对应的水合物是最强的酸,下列说法不正确的是 A. 该元素位于元素周期表的第三周期第ⅦA族 B. 该元素氢化物的水溶液显碱性 C. 该元素的单质是一种常见的氧化剂 D. 该元素的单质可用于制造漂白粉
|
|
| 17. | 详细信息 |
|
下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是 A. NH4Cl+NaOH=NaCl+NH3↑+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3↑ C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=4NaOH+O2↑
|
|
| 18. | 详细信息 |
|
下列实验中.可以不用温度计的是 A. 制乙烯 B. 制硝基苯 C. 制溴苯 D. 石油分馏
|
|
| 19. | 详细信息 |
|
锂硫电池放电时反应为2Li+S=Li2S,其装置如右下图所示。下列关于该电池的说法正确的是
A. Li作正极 B. 电池工作时Li被还原 C. 电子由S经导线流向Li D. 实现了化学能向电能的转化
|
|
| 20. | 详细信息 |
|
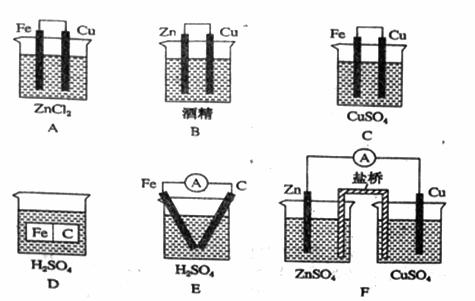
下列6个装置中,属于原电池的装置有(F中,盐桥能使离子透过一一起导电的作用)
A. 2个 B. 3个 C. 4个 D. 5个
|
|
| 21. | 详细信息 |
|
A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等. (1)W2-离子的结构示意图为 ,E元素在周期表中的位置 (2)经测定A2W2为二元弱酸,A2W2的电子式为 ,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。 (3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀成.当消耗2mol I﹣时,共转移3mol电子,该反应的离子方程式是 。 (4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,写出该反应方程式 ,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是 L(标准状况下)。
|
|
| 22. | 详细信息 |
|
某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去): ①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束; ②关闭a、c,打开b、d,向A中鼓入足量热空气; ③进行步骤②的同时,向B中通入足量SO2; ④关闭b,打开a,再通过A向B中缓慢通入足量Cl2; ⑤将B中所得液体进行蒸馏,收集液溴。 请回答: (1)步骤②中鼓入热空气的作用为_____________________________; (2)步骤③中发生的主要反应的离子方程式为______________________________。 (3)此实验中尾气可用______(填选项字母)吸收处理。 a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCI溶液 (4)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,该反应的化学方程式为____________。 (5)与B装置相比,采用C装置的优点为____________。
|
|

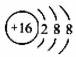

 B.
B. 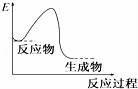
 D.
D.