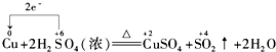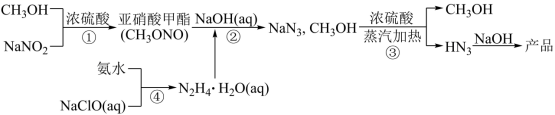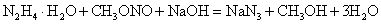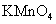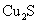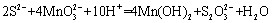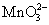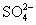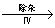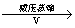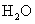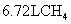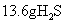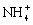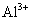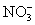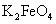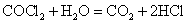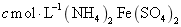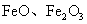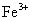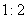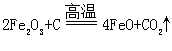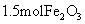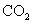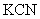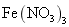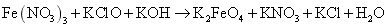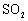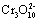高中化学必修一2020-2021学年度——氧化还原反应综合复习题含详解
| 1. | 详细信息 |
|
下列属于置换反应的是 ( ) A . 2NaHCO 3 =Na 2 CO 3 +CO 2 ↑+H 2 O B . Na 2 O+H 2 O=2NaOH C . 2KI+Br 2 =2KBr+I 2 D . MgO+2HCl=MgCl 2 +H 2 O |
|
| 2. | 详细信息 |
|
下列物质能将 Fe 3+ 转化为 Fe 2+ 的有 ①新制氯水 ②铁 ③铜 ④稀硫酸 A . ①②③ B . ③④ C . ②③ D . ①②③④ |
|
| 3. | 详细信息 |
|
化学反应 Mg(OH) 2 A . 化合反应 B . 分解反应 C . 置换反应 D . 复分解反应 |
|
| 4. | 详细信息 |
|
下列属于置换反应,且氧化剂与还原剂的物质的量之比为 2 : 1 的是 ( ) A . 2KI+Cl 2 =2KCl+I 2 B . 2FeCl 3 +Cu=2FeCl 2 +CuCl 2 C . TiO 2 +2Cl 2 |
|
| 5. | 详细信息 |
|
反应 2CO+2NO A . CO B . NO C . CO 2 D . N 2 |
|
| 6. | 详细信息 |
|
根据反应式: (1)2Fe 3+ +2I - =2Fe 2+ +I 2 (2)Br 2 +2Fe 2+ =2Br - +2Fe 3+ 判断离子的还原性由强到弱的顺序 A . Br - 、 Fe 2+ 、 I - B . I - 、 Fe 2+ 、 Br - C . Br - 、 I - 、 Fe 2+ D . Fe 2+ 、 I - 、 Br - |
|
| 7. | 详细信息 |
|
一定量的某磁黄铁矿 ( 主要成分 Fe x S , S 为 -2 价 )与 100 mL 盐酸恰好完全反应 ( 矿石中其他成分不与盐酸反应 ) ,生成 2.4 g 硫单质、 0.425 mol FeCl 2 和一定量 H 2 S 气体,且溶液中无 Fe 3+ ,则下列说法不正确的是 A . 该磁黄铁矿中 Fe x S 的 x=0.875 B . 该盐酸的物质的量浓度为 8.5 mol/L C . 生成的 H 2 S 气体在标准状况下的体积为 9.52 L D . 该磁黄铁矿 Fe 、 S 中, Fe 2+ 与 Fe 3+ 的物质的量之比为 11 : 6 |
|
| 8. | 详细信息 |
|
我国古代四大发明之一的黑火药是有硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸式的反应方程式为: S+2KNO 3 +3C=K 2 S+N 2 ↑+3CO 2 ↑ ,该反应氧化产物和还原产物的物质的量之比为 A . 1 : 3 B . 3 : 1 C . 2 : 3 D . 3 : 2 |
|
| 9. | 详细信息 |
|
ClO 2 是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得 ClO 2 : 2KClO 3 +H 2 C 2 O 4 +H 2 SO 4 =2ClO 2 ↑+K 2 SO 4 +2CO 2 ↑+2H 2 O 。下列说法正确的是 ( ) A . KClO 3 在反应中得到电子 B . KClO 3 被氧化 C . H 2 C 2 O 4 在反应中被还原 D . 1molKClO 3 参加反应有 2mol 电子转移 |
|
| 10. | 详细信息 | |||||||||||||||
|
我国古诗词或谚语中包含丰富的化学知识,下列解释正确的是 ( )
A . A B . B C . C D . D |
||||||||||||||||
| 11. | 详细信息 |
|
ClO 2 是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得 ClO 2 : A . KClO 3 在反应中得到电子 B . ClO 2 是还原产物 C . H 2 C 2 O 4 发生氧化反应 D . 生成 1 个 H 2 O 时反应过程中有 2 个电子转移 |
|
| 12. | 详细信息 |
|
下列化学反应中,电子转移的表示方法正确的是 ( ) A . B . C . D . |
|
| 13. | 详细信息 |
|
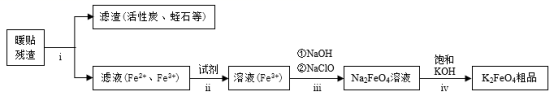
高铁酸钾 (K 2 FeO 4 ) 是一种新型的污水处理剂。为充分利用资源,变废为宝,在实验室中探究采用暖贴残渣制备高铁酸钾,流程如下 下列说法不正确的是 A . 步骤 i 适当加热搅拌可以加快反应速率 B . ii 中的试剂为 H 2 O 2 C . iii 中反应为 2Fe 3+ + 10H 2 O +3ClO - =2 FeO D . iv 中反应说明溶解度: Na 2 FeO 4 > K 2 FeO 4 |
|
| 14. | 详细信息 |
|
某金属冶炼厂排放的 SO 2 气体用酸性 Fe 2 (SO 4 ) 3 溶液吸收,然后通入空气使吸收液再生后循环利用。下列说法错误的是 A . 氧化性: O 2 >Fe 3+ > B . 若有 3molSO 2 被吸收,则至少需要消耗 1.5molO 2 才能使 Fe 2 (SO 4 ) 3 溶液再生 C . 每经过一次吸收、再生过程, Fe 2 (SO 4 ) 3 溶液的 pH 先增大后减小 D . 根据上述过程的反应原理推断: O 2 能将 Na 2 SO 3 氧化成 Na 2 SO 4 |
|
| 15. | 详细信息 |
|
已知 Na 2 S 2 O 4 ( 连二亚硫酸钠 ) 是一种重要的化学用品,不溶于乙醇,溶于氢氧化钠溶液,遇少量水发生强烈反应,甚至会引发燃烧,其相关性质说法 不正确 的是 A . Na 2 S 2 O 4 具有还原性,可用做抗氧化剂 B . Na 2 S 2 O 4 应干燥密封保存在低温处 C . 能在空气中反应生成两种新盐: Na 2 S 2 O 4 +O 2 +H 2 O = NaHSO 3 +NaHSO 4 ,生成 1mol NaHSO 4 转移电子 2mol D . 锌粉法是制备 Na 2 S 2 O 4 的常用方法,原料为锌粉悬浊液、二氧化硫和氢氧化钠溶液,反应中二氧化硫被还原 |
|
| 16. | 详细信息 |
|
下列文献记载内容不涉及氧化还原反应的是 ( ) A . 《本草纲目》中 “ 令人以灰 ( 草木灰 ) 淋汁,取碱浣衣 ” B . 《梦溪笔谈》中 “ 熬胆矾铁釜,久之亦化为铜 ” C . 《抱朴子》中 “ 丹砂 (HgS) 烧之成水银,积变又还成丹砂 ” D . 《周易参同契》中 “ 胡粉 ( 碱式碳酸铅 ) 投火中,色坏还为铅 ” |
|
| 17. | 详细信息 |
|
有关反应 5Cu+4H 2 SO 4 ( 浓 ) A . 氧化剂与还原剂的物质的量之比为 1 : 5 B . 每有 1mol Cu 参加反应时转移 2mol C . 氧化产物只有 D . 浓硫酸既是氧化剂又是还原剂 |
|
| 18. | 详细信息 |
|
已知还原性强弱: SO 2 >I - >Fe 2+ >Cl - ,判断下列反应不能发生的是 ( ) A . SO 2 +2Fe 3+ +2H 2 O=2Fe 2+ +4H + +SO C . I 2 +2Cl - =Cl 2 +2I - D . 2Fe 3+ +2I - =2Fe 2+ +I 2 |
|
| 19. | 详细信息 |
|
下列反应中,水既不做氧化剂又不做还原剂的是 ( ) A . 2Na+2H 2 O=2NaOH+H 2 ↑ B . 2H 2 O=2H 2 ↑+O 2 ↑ C . 2NaCl+2H 2 O=2NaOH+H 2 ↑+Cl 2 ↑ D . 3NO 2 +H 2 O=2HNO 3 +NO |
|
| 20. | 详细信息 |
|
下列 4 组物质中,能发生反应且既属于离子反应又属于氧化还原反应的是 ( ) A . 硫酸钠溶液与氯化钡溶液 B . 铝片与硝酸铜溶液 C . 稀硫酸与铜片 D . 硝酸钠溶液与氯化钾溶液 |
|
| 21. | 详细信息 |
|
下列反应属于氧化还原反应的是 ( ) A . Na 2 SO 3 +H 2 SO 4 ( 浓 )=SO 2 ↑+H 2 O+Na 2 SO 4 B . 2HClO C . CaO+H 2 O=Ca(OH) 2 D . NaCl+NH 3 +CO 2 +H 2 O=NaHCO 3 ↓+NH 4 Cl |
|
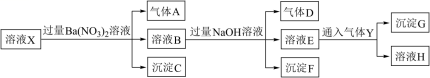
| 22. | 详细信息 |
|
反应 MnO 2 +4HCl( 浓 ) A . MnO 2 B . HCl C . MnCl 2 D . Cl 2 |
|
| 23. | 详细信息 |
|
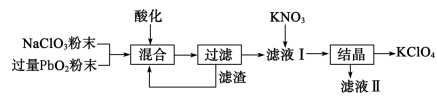
工业用强氧化剂 PbO 2 来制备 KClO 4 的工业流程如图: 下列判断不正确的是 ( ) A . “ 滤渣 ” 的主要成分是 PbO 2 ,可循环使用 B . “ 酸化 ” 的试剂可用浓盐酸 C . NaClO 3 与 PbO 2 反应的物质的量之比为 1 : 1 D . 在滤液 1 中加入 KNO 3 制得 KClO 4 利用的是体系中各物质溶解度不同 |
|
| 24. | 详细信息 |
|
已知反应: ① 2BrO A . ClO C . BrO |
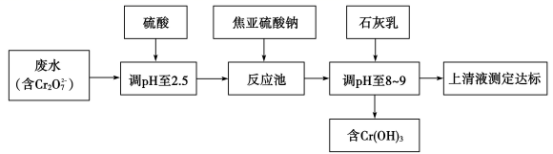
|
| 25. | 详细信息 |
|
下列应用不涉及氧化还原反应的是 A . 小苏打用作食品膨松剂 B . 工业合成氨实现人工固氮 C . 烟气脱硫 (SO 2 ) 生产硫酸 D . 利用铝热反应焊接钢轨 |
|
| 26. | 详细信息 |
|
科学家开发出一种低成本光伏材料 —— 蜂窝状石墨烯,生产原理是: Na 2 O+ 2CO A . 石墨烯与金刚石互为同素异形体 B . Na 2 O 属于碱性氧化物 C . Na 2 CO 3 为氧化产物 D . 每 2mol CO 分子参加反应转移 4mol 电子 |
|
| 27. | 详细信息 |
|
化学社的同学查阅资料发现,工业上曾经通过反应 “ 3Fe+4NaOH A . 还原产物是钠 Na 和 B . 用磁铁可以将 Fe 与 C . 将生成的气体在空气中冷却可获得钠 D . 每生成 1molH 2 ,该反应转移的电子数约为 |
|
| 28. | 详细信息 |
|
在反应 H 2 S+H 2 SO 4 =S↓+SO 2 ↑+2H 2 O 中,若有 64g 硫生成则转移电子为 ( ) A . 12mol B . 4mol C . 6mol D . 8mol |
|
| 29. | 详细信息 |
|
下列物质的转化,需要加入还原剂才能实现的是 ( ) A . Cl - →Cl 2 B . SO |
|
| 30. | 详细信息 |
|
叠氮酸钠 (NaN 3 ) 是重要的化工原料。以甲醇、亚硝酸钠等为原料制备 NaN 3 流程如下: 已知水合肼 (NH 4 ·H 2 O) 不稳定,具有强还原性。下列描述错误的是 A . 反应 ①和反应③中浓硫酸作用不同 B . 反应 ②的化学方程式: C . 步骤 ③分离出的 CH 3 OH 可导入 ①中循环利用 D . 反应 ④制备水合肼时应将氨水逐滴滴入 NaClO 溶液中 |
|
| 31. | 详细信息 |
|
已知反应 : ① 2KMnO 4 + 16HCl = 2MnCl 2 + 2KCl + 5Cl 2 ↑+ 8H 2 O , ② Cl 2 + 2FeCl 2 = 2FeCl 3 , ③ 2FeCl 3 + Cu = 2FeCl 2 + CuCl 2 ,可以判断氧化性强弱顺序正确的是 ( ) A . KMnO 4 > CuCl 2 > FeCl 3 > Cl 2 B . KMnO 4 < Cl 2 < FeCl 3 < CuCl 2 C . KMnO 4 > Cl 2 > FeCl 3 > CuCl 2 D . Cl 2 > FeCl 3 > CuCl 2 > KMnO 4 |
|
| 32. | 详细信息 |
|
氢化钠( NaH )可在野外用作生氢剂,化学反应原理为: NaH+ H 2 O=NaOH+H 2 ↑。下列说法不正确的是( ) A . 氢化钠( NaH )中氢元素化合价为 -1 价 B . 该反应每转移 1mol 电子,生成 22.4L (标准状况下)的氢气 C . H 2 O 在反应中做氧化剂被还原 D . 氢氧化钠是氧化产物 |
|
| 33. | 详细信息 |
|
下列反应属于氧化还原反应的是 A . CaCO 3 +2HCl=CaCl 2 +H 2 O+CO 2 ↑ B . CaO+H 2 O=Ca(OH) 2 C . CaCO 3 |
|
| 34. | 详细信息 |
|
用酸性 A . 反应 I 中 B . 反应 I 中每生成 C . 反应 II 中氧化剂与还原剂的物质的量之比为 D . 若反应 I 和反应 II 中消耗的 |
|
| 35. | 详细信息 |
|
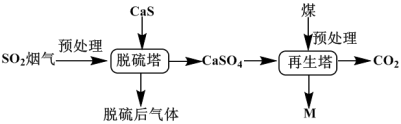
二氧化硫的减排和回收已成为环保领域急需解决的重大课题,某研究团队提出如下还原脱硫流程,脱硫塔中反应为: ( A . 脱硫塔的反应中氧化剂与还原剂的物质的量之比为 B . 硫可以形成分子式为 C . 脱硫后的气体冷凝可以获得单质 D . 物质 M 可以循环使用 |
|
| 36. | 详细信息 |
|
下列化学方程式中属于复分解反应的是 ( ) A . C + O 2 C . 3CO + Fe 2 O 3 |
|
| 37. | 详细信息 |
|
下列离子方程式书写正确的是 A . 大理石与醋酸反应: B . 稀硫酸和氢氧化钡溶液反应: H + + C . 澄清石灰水与碳酸钠溶液反应: Ca(OH) 2 + D . Fe 2+ 与 H 2 O 2 在酸性溶液中的反应: 2Fe 2+ +H 2 O 2 +2H + =2Fe 3+ +2H 2 O |
|
| 38. | 详细信息 |
|
下列反应类型中一定属于氧化还原反应的是 A . 置换反应 B . 复分解反应 C . 化合反应 D . 分解反应 |
|
| 39. | 详细信息 |
|
已知常温下可用: Co 2 O 3 制备 Cl 2 ,反应前后存在六种微粒: Co 2 O 3 、 H 2 O 、 Cl 2 、 H + 、 Cl - 和 Co 2+ 。下列叙述不正确的是 ( ) A . 氧化产物为 Cl 2 B . 氧化剂与还原剂的物质的量之比为 1 ∶ 2 C . 若有 1molCl 2 生成,则反应前 HCl 的物质的量为 6mol D . 当该反应生成 4.48LCl 2 时,反应中有 0.2mol 电子转移 |
|
| 40. | 详细信息 |
|
火星大气中含有 95% 的二氧化碳。某课题组研制出 “Na ﹣ CO 2 ” 电池,其工作原理为: 3CO 2 +4Na=2Na 2 CO 3 +C 。下列分析错误的是 ( ) A . CO 2 部分发生还原反应 B . 1molNa 完全反应失去 1mole ﹣ C . 氧化剂与还原剂物质的量之比为 3 ∶ 4 D . 该研究可能为火星探测提供一种潜在能源系统 |
|
| 41. | 详细信息 |
|
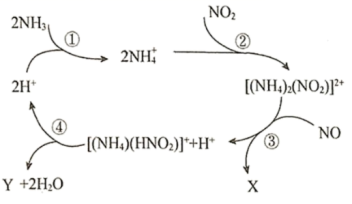
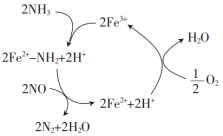
某种类型的心脏起搏器工作时发生下列反应: A . 还原剂只有 C . 还原产物包括 |
|
| 42. | 详细信息 |
|
工业上用发烟 HClO 4 能把潮湿的 CrCl 3 氧化为棕色的烟 A . 该反应,反应物和生成物中的酸均为强酸 B . CrO 2 (ClO 4 ) 2 与 K 2 Cr 2 O 7 中 Cr 元素的化合价相同 C . 该反应每生成 1mol 氧化产物,便有 0.375molHClO 4 被还原 D . 该反应的离子方程式为 19ClO |
|
| 43. | 详细信息 |
|
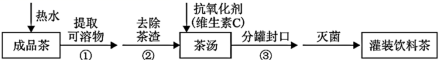
饮茶是中国人的传统饮食文化之一。为方便饮用,可通过以下方法制取罐装饮料茶: 关于上述过程涉及的实验方法、实验操作和物质作用中说法正确的是 ( ) A . ①是蒸馏 B . ②是过滤 C . 维生素 C 作分散剂 D . ③是分液 |
|
| 44. | 详细信息 |
|
下列变化中,必须加入还原剂才能实现的是 ( ) A . MgCl 2 →Cl 2 B . FeCl 3 →FeCl 2 C . NH 3 →NO D . SO 2 →Na 2 SO 3 |
|
| 45. | 详细信息 |
|
模型认知是化学学科要求的核心素养之一,从元素化合价的角度分析,下列物质既有氧化性,又有还原性的是 A . Al B . Fe C . S D . Na |
|
| 46. | 详细信息 |
|
利用 Cu-ZSM-5 分子筛催化剂, NH 3 可脱除燃煤烟气中的 NO 和 NO 2 ,生成两种无毒物质,其反应历程如图所示,下列说法不正确的是 A . 该去除氮氧化物的总反应中,标况下每生成 2.24 L 氮气,转移的电子数为 0.6 N A B . X 是氮气和水的混合物 C . 阶段 ④中的氮元素既被氧化又被还原 D . 阶段 ②中各元素的化合价没有发生变化 |
|
| 47. | 详细信息 |
|
火法炼铜的原理 Cu 2 S+O 2 A . 该反应中的氧化剂只有 O 2 B . 被 0.3mol O 2 氧化的 Cu 2 S 中的硫元素的质量为 9.6 g C . 每生成 2.24L SO 2 电子转移的总数约为 6×6.02×10 22 D . 无论是火法炼铜还是湿法炼铜,反应中铜元素都发生还原反应 |
|
| 48. | 详细信息 |
|
反应 4NH 3 +3F 2 =NF 3 +3NH 4 F 中,氧化剂与还原剂的物质的量之比是 ( ) A . 3 : 1 B . 2 : 1 C . 1 : 3 D . 1 : 1 |
|
| 49. | 详细信息 |
|
工业上可利用如下反应检查输送氯气的管道是否漏气: 3Cl 2 +8NH 3 =N 2 +6NH 4 Cl( 反应中产生的白烟为 NH 4 Cl 小颗粒 ) 。下列有关该反应的说法中,不正确的是 ( ) A . 属于置换反应 B . Cl 2 表现强氧化性 C . 氧化剂和还原剂的物质的量之比为 3 ∶ 8 D . 生成 1molN 2 ,有 6mol 电子转移 |
|
| 50. | 详细信息 | ||||||||||||
|
下列过程中发生了氧化还原反应的是
A . A B . B C . C D . D |
|||||||||||||
| 51. | 详细信息 |
|
Na 2 Sx 在碱性条件下可被 NaClO 氧化为 Na 2 SO 4 ,而 NaClO 被还原为 NaCl ,若反应中 Na 2 S x 与 NaClO 的个数比为 1 : 16 ,则 x 值为 A . 2 B . 3 C . 4 D . 5 |
|
| 52. | 详细信息 |
|
反应 8NH 3 +3Cl 2 =N 2 +6NH 4 Cl ,体现还原性的 NH 3 与体现碱性的 NH 3 的物质的量之比为 A . 8 : 3 B . 3 : 1 C . 1 : 3 D . 34 : 213 |
|
| 53. | 详细信息 |
|
用下列方法均可制得氯气: ① MnO 2 +4HCl( 浓 ) ② KClO 3 +6HCl( 浓 )=KCl+3Cl 2 ↑+3H 2 O 若要制得相同质量的氯气, ①②反应中电子转移数目之比为 A . 1 : 1 B . 1 : 3 C . 6 : 5 D . 1 : 6 |
|
| 54. | 详细信息 |
|
已知如下反应: ① Cl 2 +2Br ﹣ =2C1 ﹣ +Br 2 ② 2Fe 2+ +Br 2 =2Fe 3+ +2Br ﹣ ③ 2Fe 3+ +2I ﹣ =2Fe 2+ +I 2 ,则有关离子的还原性由强到弱的顺序为 A . I ﹣ >Fe 2+ >Br ﹣ >Cl ﹣ B . Fe 2+ >Br ﹣ >Cl ﹣ >I ﹣ C . Br ﹣ >Cl ﹣ >Fe 2+ >I ﹣ D . Fe 2+ >I ﹣ >Br ﹣ >Cl ﹣ |
|
| 55. | 详细信息 |
|
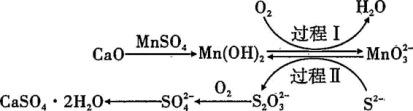
利用空气催化氧化法除掉电石渣浆 ( 含 CaO) 上清液中的 S 2− ,制取石膏 (CaSO 4 ·2H 2 O) 的过程如图。下列说法正确的是 A . 过程 Ⅰ 后溶液 pH 减小 B . 过程 Ⅱ 中,反应的离子方程式为 C . Mn(OH) 2 和 D . 将 10 L 上清液中的 S 2− (S 2− 浓度为 480 mg·L −1 ) 转化为 |
|
| 56. | 详细信息 |
|
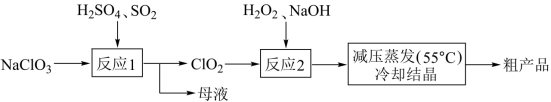
以氯酸钠 (NaClO 3 ) 等为原料制备亚氯酸钠 ( NaClO 2 ) 的工艺流程如下,下列说法不正确的是 A . 反应 1 中,每生成 3 mol ClO 2 有 1.5 mol SO 2 被氧化 B . 从母液中可以提取 Na 2 SO 4 C . 反应 2 中, H 2 O 2 做氧化剂 D . 采用减压蒸发可能是为了防止 NaClO 2 受热分解 |
|
| 57. | 详细信息 |
|
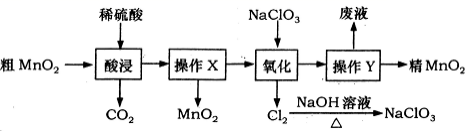
MnO 2 是一种重要的无机功能材料,利用粗 MnO 2 ( 含有杂质 MnO 和 MnCO 3 ) 制取 MnO 2 的流程如图所示。 下列分析错误的是 ( ) A . 操作 X 和操作 Y 的名称均为过滤 B . CO 2 是酸性氧化物, MnO 2 是碱性氧化物 C . “ 氧化 ” 过程中氧化剂与还原剂的物质的量之比为 2 : 5 D . Cl 2 与 NaOH 溶液反应,每生成 42.6g NaClO 3 转移电子数为 2 N A |
|
| 58. | 详细信息 |
|
F 2 和 Xe 在一定条件下生成氧化性极强且极易与水反应的 XeF 2 、 XeF 4 和 XeF 6 三种化合物。其中 XeF 4 与 H 2 O 可以发生如下反应: 6XeF 4 +12H 2 O=2XeO 3 +4Xe↑+24HF+3O 2 ↑ 。下列判断正确的是 ( ) A . XeF 2 加入水中,在水分子的作用下,将重新生成 Xe 和 F 2 B . XeF 4 按以上方式与水反应,每生成 3mol O 2 转移 12mol 电子 C . 上述反应中氧化剂和还原剂的物质的量之比为 2 : 1 D . XeF 2 、 XeF 4 和 XeF 6 在空气中都不能长期存放 |
|
| 59. | 详细信息 |
|
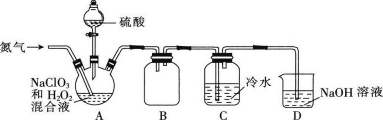
二氧化氯 (ClO 2 ) 是一种黄绿色气体,易溶于水,熔点为﹣ 59.5℃ ,沸点为 11.0℃ ,浓度过高时易发生分解引起爆炸,制备二氧化氯溶液的装置如图。下列说法正确的是 ( ) A . 装置 A 发生的反应中氧化剂与还原剂的物质的量之比为 1 : 2 B . 实验中氮气的作用就是将装置内的空气排出 C . 装置 B 可以起到防止倒吸的作用 D . 当看到装置 C 中导管液面上升时应减慢氮气的通入速率 |
|
| 60. | 详细信息 |
|
ClO 2 是一种新型水处理剂,工业上用 NaClO 2 与盐酸反应制备 ClO 2 的反应情况如下: ①5NaClO 2 +4HCl( 稀 )=5NaCl+4ClO 2 ↑+2H 2 O②NaClO 2 +4HCl( 浓 )=NaCl+2Cl 2 ↑+2H 2 O 。则根据上述信息得出的下列有关说法中正确的是 ( ) A . 盐酸浓度越大,其还原性也越强 B . 两个反应中 HCl 均同时表现出酸性和还原性 C . 反应 ① 中每生成 1 mol ClO 2 转移电子量为 4 mol D . 反应 ② 中氧化剂与还原剂的物质的量之比为 |
|
| 61. | 详细信息 |
|
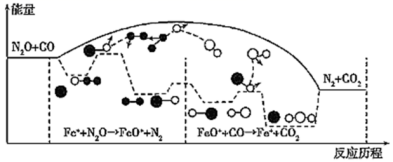
研究表明 CO 与 N 2 O 在 Fe + 作用下发生反应的能量变化及反应历程如图所示,两步反应分别为: ① N 2 O+Fe + =N 2 +FeO + ( 慢 ) 、 ② FeO + +CO=CO 2 +Fe + ( 快 ) 。下列说法正确的是 A . 反应 ①是氧化还原反应,反应②是非氧化还原反应 B . 升高温度,总反应的平衡常数 K 减少 C . Fe + 使反应的活化能减小, FeO + 是中间产物 D . 若转移 1mol 电子,则消耗标况下 22.4LN 2 O |
|
| 62. | 详细信息 | ||||||||||
|
Ⅰ. 现有下列十种物质: ① O 2 ② H 2 SO 4 ③ CaO ④ Fe ⑤ CO 2 ⑥ Ba(OH) 2 ⑦红褐色的氢氧化铁胶体 ⑧稀硝酸 ⑨硫酸钠溶液 ⑩ Cu 2 (OH) 2 CO 3 (1) 按物质的分类法填写表格的空白处:
(2) 上述十种物质中有两种物质之间可发生离子反应: H + +OH - = H 2 O ,该离子反应对应的化学反应方程式为 _______ 。 (3) 少量 ⑤与⑥发生反应的离子方程式为 _______ 。 Ⅱ. 高铁酸盐在能源、环保等方面有着广泛的用途,湿法制备高铁酸盐的原理为 3ClO − +10OH − +2Fe 3+ =2 高铁酸根 ( |
|||||||||||
| 63. | 详细信息 |
|
有反应 ① 2H 2 O+Cl 2 +SO 2 =H 2 SO 4 +2HCl , ② 2KMnO 4 +16HCl=2KCl+2MnCl 2 +5Cl 2 ↑+8H 2 O 。针对上述两个反应回答下列问题: (1) 两反应中的氧化剂的氧化性强弱顺序为 ___ ,还原剂的还原性强弱顺序为 ___ 。 (2) 反应 ②中氯化氢表现出的性质是 ___ ( 填字母 ) 。 a. 还原性 b. 酸性 c. 氧化性 (3) 指出反应 ②的氧化剂 ___ ,氧化产物 ___ ,用双线桥法标出反应 ②电子转移 ___ 。 |
|
| 64. | 详细信息 |
|
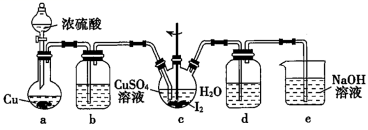
|
|
| 65. | 详细信息 |
|
亚氯酸钠 (NaClO 2 ) 是一种高效氧化剂、漂白剂。在 NaOH 溶液中 ClO 2 与 H 2 O 2 反应可以得到亚氯酸钠。 ______ ClO 2 +_____ H 2 O 2 +______ NaOH=______NaClO 2 + _______O 2 ↑+ ________H 2 O (1)ClO 2 中氯元素的化合价是 ___________ ;在制备亚氯酸钠的反应中 ClO 2 作 ___________ ( 填 “ 氧化剂 ” 或 “ 还原剂 ”) ,对应的性质 ClO 2 ___________ O 2 ( 填 “ 强于 ” 或 “ 弱于 ”) 。 (2) 若反应中生成 2 个 O 2 ,转移电子的个数为 ___________ 。 (3) 配平该反应化学方程式,从左往右的系数依次为 ___________ 。 |
|
| 66. | 详细信息 |
|
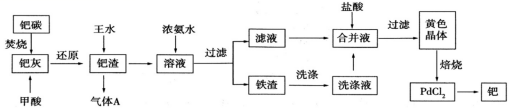
钯 (Pd) 是一种不活泼金属,含钯催化剂在工业、科研上用量较大。某废钯催化剂 ( 钯碳 ) 中含有钯 (5% ~ 6%) 、碳 (93% ~ 94%) 、铁 (1% ~ 2%) 以及其他杂质,故钯碳具有很高的回收价值。如图是利用钯碳制备氯化钯 (PdCl 2 ) 和 Pd 的流程。 (1)“ 钯碳 ” 焚烧过程中空气一定要过量,目的是 _______ 。 (2)“ 钯灰 ” 中的主要成分有 PdO ,加入甲酸 (HCOOH) ,可以将 PdO 还原成金属单质,请写出 HCOOH 还原 PdO 的化学方程式 ________ 。 (3) 王水是按照体积比 3 : 1 将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成 |
|
| 67. | 详细信息 |
|
用软锰矿 ( 主要成分为 MnO 2 ,含少量 Fe 3 O 4 、 Al 2 O 3 ) 和 BaS 制备高纯 MnCO 3 的工艺流程如下: 软锰矿预先粉碎的目的是 ____________ , MnO 2 与 BaS 溶液反应转化为 MnO 的化学方程式为 ________ 。 |
|
| 68. | 详细信息 |
|
H 2 O 2 是一种重要的化学品,其合成方法不断发展。 早期制备方法: Ba(NO 3 ) 2 I 为分解反应,产物除 BaO 、 O 2 外,还有一种红棕色气体。该反应的化学方程式是 ____ 。 |
|
| 69. | 详细信息 |
|
(1) 现有下列 13 种物质: ① (2) 标准状况下有 ① (3) 在 |
|
| 70. | 详细信息 |
|
(1) ① H 2 +CuO ② CaCO 3 +2HCl=CaCl 2 +CO 2 ↑+H 2 O ③ 3S+6NaOH ④ NH 4 NO 3 +Zn=ZnO+N 2 ↑+2H 2 O ⑤ Cu 2 O+4HCl=2HCuCl 2 +H 2 O 上述反应中,属于氧化还原反应的是 _______ ( 填序号 ) 。 (2) 配平下面氧化还原反应的化学方程式: KMnO 4 +SO 2 +H 2 O—K 2 SO 4 +MnSO 4 +H 2 SO 4 ___ ( 写配平后的整个方程式 ) 。 |
|
| 71. | 详细信息 |
|
现有下列物质: ① Na 2 CO 3 • 10H 2 O 晶体 ②铜 ③硫酸溶液 ④ CO 2 ⑤ NaHSO 4 固体 ⑥ Ba ( OH ) 2 固体 ⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩ Al 2 ( SO 4 ) 3 固体。 ( 1 )上述物质属于电解质的有 _______ (填编号)。 ( 2 )上述物质中有两种物质之间可发生离子反应: H + + OH - = H 2 O ,写出该离子反应对应的化学方程式 _______ 。 ( 3 )将⑤的溶液滴加到⑥的溶液中至溶液恰好呈中性的离子方程式 _______ 。将 ⑤的溶液滴加到⑥的溶液中至溶液 Ba 2 + 恰好沉淀完全的离子方程式 _______ 。 ( 4 )误食亚硝酸钠( NaNO 2 )会使人体血液中的 Fe 2 + 转化为 Fe 3 + 而引起中毒,服用维生素 C 可使 Fe 3 + 转化为 Fe 2 + ,从而达到解毒的目的。由此可见,在解毒反应中,维生素 C 表现 _______ 性 |
|
| 72. | 详细信息 |
|
对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。 I. 现有以下物质: ① H 2 O ② Cu ③ BaCO 3 ④ Fe(OH) 3 胶体 ⑤酒精 ⑥ CO 2 ⑦稀硫酸 (1) 以上物质中属于混合物的是 __ ( 填序号,下同 ) ,属于电解质的是 ____ 。 II. 虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。 (2) 下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是 ___ ( 填字母,下同 ) 表示置换反应的是 ____ 。 (3) 有同学认为所有酸碱中和反应均可表示为 H + +OH - =H 2 O 。请举个例子反驳上述观点 ( 用离子方程式表示 ) _______ 。 |
|
| 73. | 详细信息 |
|
请依据下列情景回答下列问题: (1) 实验室可用 KMnO 4 和浓盐酸反应制取氯气,化学反应方程式如下: 2KMnO 4 +16HCl( 浓 )=2KCl+2MnCl 2 +5Cl 2 ↑+8H 2 O ①浓盐酸在反应中表示出来的性质是 _______ 。 A. 只有还原性 B. 还原性和酸性 C. 只有氧化性 D. 氧化性和酸性 ②该反应中氧化剂与还原剂的物质的量之比是 _______ 。 ③该反应中产生了 0.25molCl 2 ,转移的电子为 _______ mol 。 (2) 根据反应 3Cu+8HNO 3 ( 稀 )=3Cu(NO 3 ) 2 +2NO↑+4H 2 O ,回答下列问题: ①还原产物是 _______ 。 ②如果反应中转移了 0.15 mol 电子,则产生的气体在标准状况下体积为 _______ L 。 |
|
| 74. | 详细信息 |
|
已知反应: 2Al + 6HCl = 2AlCl 3 + 3H 2 ↑,按要求完成下列问题:该反应的还原剂是 _______ ,氧化剂是 _______ ,氧化产物是 _______ ,当有 10 . 8 克铝反应时该反应转移的电子数为 _______ 。 |
|
| 75. | 详细信息 |
|
用双线桥表示下列反应的电子转移情况: ( 1 ) Fe 2 O 3 + 3CO = 2Fe + 3CO 2 _______ ( 2 ) 2KMnO 4 + 16HCl = 2MnCl 2 + 2KCl + 5Cl 2 ↑+ 8H 2 O _______ |
|
| 76. | 详细信息 |
|
(1) 过氧化氢俗名双氧水,有时可作为矿业废液消毒剂,有 “ 绿色氧化剂 ” 的美称。配平下列反应方程式: ______ ______H 2 O 2 +______Cr 2 (SO 4 ) 3 +______KOH—______K 2 CrO 4 +______K 2 SO 4 +______H 2 O (2) 消除采矿业胶液中的氰化物 ( 如 KCN , C 为 +2 价 ) ,经以下反应实现: KCN+H 2 O 2 +H 2 O=A+NH 3 ↑( 已配平 ) 。试指出 A 的化学式 ______ ,如此反应中有 6.72L( 标准状况 ) 气体生成,转移电子数目为 ______ |
|
| 77. | 详细信息 |
|
为测试铁片中铁元素的含量,某课外活动小组提出下面方案并进行了实验。将 0.200g 铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用 0.0200mol•L -1 的 KMnO 4 溶液滴定,达到终点时消耗了 25.00mLKMnO 4 溶液。 (1) 配平以下方程式并标出电子转移的方同与数目: ___ 。 H 2 SO 4 +KMnO 4 +FeSO 4 →MnSO 4 +Fe 2 (SO 4 ) 3 +K 2 SO 4 +H 2 O (2) 铁片中铁元素的质量分数为 ___ ;若通过仪器分析发现该小组的测量结果偏高,以下可能的情况有 ___ 。 A. 酸式滴定管洗净后,直接注入高锰酸钾溶液 B. 洗净的锥形瓶,再用待测液润洗 C. 锥形瓶中残留有少量蒸馏水 D. 滴定至终点时,在滴定管尖嘴部位有气泡 (3) 高锰酸钾溶液往往用硫酸酸化而不用盐酸酸化,原因是: ___ 。 (4)Fe 2 (SO 4 ) 3 溶液中 c(Fe 3+ ) : c(SO (5) 高锰酸钾在化学品生产中,广泛用作为氧化剂,可以氧化 H 2 O 2 、 Fe 2+ 、 S 2- 、 SO (6) 上述反应在恒温下进行,该过程中会明显看到先慢后快的反应,原因可能是 ___ 。 |
|
| 78. | 详细信息 |
|
物质王国的 “ 小朋友 ” 在做游戏,它们手拉手围成一圈 ( 如图所示 ) ,如果相邻间的物质能相互反应,表示它们能互相配合,顺利地把游戏做下去。 请回答: (1) 它们能否顺利地把游戏做下去?答: _______ (2) 请你写出其中相邻物质间能相互反应的 2 个化学方程式: ① _______ ② _______ (3) 为了让场外的 “ 小朋友 ” 也有机会参加游戏,你认为场外的哪些 “ 小朋友 ” 可以分别代替场上的哪些 “ 小朋友 ” ? ( 写 2 个 ) ① _______ 代替 _______ ; ② _______ 代替 _______ |
|
| 79. | 详细信息 |
|
(1) 现有以下物质: ① Ba(OH) 2 晶休, ②盐酸,③冰醋酸 ( 固态醋酸 ) , ④石墨,⑤酒精 (C 2 H 5 OH) ,请回答下列问题 ( 填序号 ) :以上物质中属于电解质的是 _______ 。请写出 ①在水溶液中的电离方程式 _______ 。 (2) 维生素 C 又称 “ 抗坏血酸 ” ,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的 Fe 3+ 转变为易吸收的 Fe 2+ ,这说明维生素 C 具有 _______ ( 填 “ 氧化性 ” 或 “ 还原性 ”) 。 (3) 当光束通过下列物质时,会出现丁达尔效应的是 _______ 。 ① Fe(OH) 3 胶体 ②水③蔗糖溶液④ Ca(OH) 2 悬浊液 |
|
| 80. | 详细信息 |
|
在一定温度下, KClO 3 和浓盐酸反应会生成黄绿色的易爆物二氧化氯 (ClO 2 ) ,反应的化学方程式为: _______KClO 3 +_______HCl( 浓 )=_______KCl+_______ClO 2 ↑+_______Cl 2 ↑+_______H 2 O 。请完成下列空白。 (1) 配平以上化学方程式 _______ ( 化学计量数填入横线上 ) 。 (2) 在该反应中 HCl 表现的性质是 _______ 。 (3) 在反应中产生 0.1 mol Cl 2 时,转移电子的物质的量为 _______ mol 。 (4)ClO 2 具有很强的氧化性,可被用来作自来水的消毒剂。若 ClO 2 作消毒剂后转化为 Cl - ,则其消毒的效率 ( 以单位物质的量得到的电子数表示 ) 是 Cl 2 的 _______ 倍。 |
|
| 81. | 详细信息 |
|
已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下: 3Cu+8HNO 3 ( 稀 )=3Cu(NO 3 ) 2 +2NO↑+4H 2 O 。 (1) 用双线桥 ( 或单线桥 ) 标出电子转移的方向和数目 ______ 。 (2) 被氧化的元素是 ____ ,发生氧化反应的物质是 ____ ,还原产物是 _____ 。 |
|
| 82. | 详细信息 |
|
I. 已知: Fe 2 O 3 +3CO (1) 用双线桥 ( 或单线桥 ) 标出该反应中电子转移的方向和数目 ____ 。 (2) 该反应中 ____ 被还原。 II. 有反应: Fe 2 O 3 +2Al (1) 该反应所属的基本反应类型是 _____ 。 (2) 在反应中铁元素的化合价变化是 ____ ,该元素的原子 ____ ( 填 “ 失去 ” 或 “ 得到 ”) 电子。 (3) 发生还原反应的是 _____ 。 |
|
| 83. | 详细信息 |
|
按要求完成下列填空: (1) 硫酸钡的电离方程式: _______ 。 (2) 盐酸和小苏打反应离子方程式: _______ 。 (3) 向硫酸氢钠溶液中逐滴加入氢氧化钡,溶液恰好显中性时反应的离子方程式: _______ 。 (4) 向澄清石灰水中通入过量 CO 2 反应的离子方程式: _______ 。 (5) 配平下列方程式,并用双线桥表示电子转移的数目与氧化还原、化合价变化之间的关系: |
|
| 84. | 详细信息 |
|
在测定某铁矿石中的含铁量时,可准确称取 0.2113g 铁矿石溶解在酸里,再把 Fe 3+ 还原成 Fe 2+ ,然后用 0.0223mol·L -1 的 KMnO 4 溶液滴定,发生反应的离子方程式如下: 5Fe 2+ +MnO (1) 矿石中含铁的质量分数为 ___ 。 (2)KMnO 4 溶液应装在 ___ 式滴定管里,原因是 __ 。 (3) 如果矿石是用盐酸溶解制得的, Fe 2+ 溶液里含有 Cl - ,则测定结果矿石中含铁量 __ ( 填偏高、偏低、无影响 ) ,原因是 ___ 。 |
|
| 85. | 详细信息 |
|
高铁酸钠 (Na 2 FeO 4 ) 是水处理过程中使用的一种新型净水剂作剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为 Fe 2+ 离子.配平制取铁酸钠的化学方程式: ______Fe(NO 3 ) 3 +______NaOH+______Cl 2 ═____Na 2 FeO 4 +____NaCl+6NaNO 3 +8H 2 O . _______ ,反应中, ______ 元素被氧化,每生成 8mol H 2 O 转移电子总数为 ________ 。 |
|
| 86. | 详细信息 |
|
某强酸性溶液 X 中可能含有 回答下列问题: (1) 溶液 X 中肯定存在的离子有 _______ 。 (2) 写出生成气体 A 的离子方程式 _______ 。 (3) 写出向溶液 E 中通入少量 Y 时一定发生的离子方程式 _______ 。 (4) 则溶液中可能存在的离子 _______ 。 (5) 由沉淀 F 在 KOH 溶液中与 KClO 反应可制得一种新型、高效、多功能水处理剂 ① ② 完成并配平下列方程式: ____+KClO+KOH→____+KCl+H 2 O , _________ 。 |
|
| 87. | 详细信息 |
|
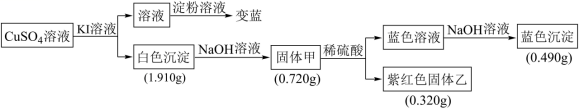
已知 CuSO 4 和 KI 在一定条件下可发生反应,相关实验流程和结果如图: (1) 蓝色沉淀的化学式为 _______ ,使淀粉溶液变蓝的物质的电子式为 _______ 。 (2) 固体甲与稀硫酸反应的离子方程式为 _______ 。 (3) 流程中生成白色沉淀的离子方程式为 _______ 。 |
|
| 88. | 详细信息 |
|
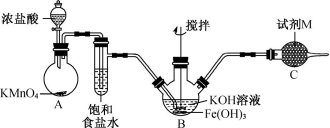
新型净水剂高铁酸钾 I 、湿式氧化法制备 (1)A 中反应的离子反应为 ________________ 。 (2) 实验过程中发现浓盐酸不能持续滴下,装置的改进方案是 ________________________ (3)B 中得到紫色固体和溶液, B 中反应的化学方程式为 ________________________ 。 (4) 试剂 M 是 ________ ,其作用为 ________________________ 。 II 、实验室模拟工业电解法制取 (5) (6) (7) 高铁电池是正在研制中的可充电干电池,图 2 为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ________ 、 ________ 。 |
|
| 89. | 详细信息 |
|
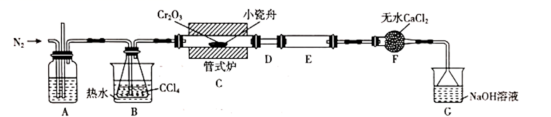
三氯化铬 (CrCl 3 ) 是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室利用反应 已知: ① COCl 2 ( 俗称光气 ) 有毒,遇水发生水解: ②碱性条件下, H 2 O 2 将 Cr 3+ 氧化为 回答下列问题: (1)A 中的试剂为 _______ ;无水 CaCl 2 的作用是 _______ ;反应结束后继续通入一段时间氮气,主要目的是 _______ 。 (2) 装置 E 用来收集产物,实验过程中若 D 处出现堵塞,可观察到的现象是 _______ ;可通过 _______ ( 填操作 ) ,使实验能继续进行。 (3) 装置 G 中发生反应的离子方程式为 _______ 。 (4) 测定产品中 CrCl 3 质量分数的实验步骤如下: I. 取 m g CrCl 3 产品,在强碱性条件下,加入过量的 30% H 2 O 2 溶液,小火加热使 CrCl 3 完全转化为 Ⅱ . 冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸 ( 加浓磷酸的目的是为了防止指示剂提前变色 ) ,使 Ⅲ . 用新配制的 ①产品中 CrCl 3 质量分数表达式为 _______ 。 ②下列操作将导致产品中 CrCl 3 质量分数测定值偏低的是 _______ ( 填标号 ) 。 a. 步骤 Ⅰ中未继续加热一段时间 b. 步骤 Ⅱ中未加浓磷酸 c. 步骤 Ⅲ中所用 d. 步骤 Ⅲ中读数时,滴定前俯视,滴定后平视 |
|
| 90. | 详细信息 |
|
实验室用酸性蚀刻废液 ( 含 Cu 2+ 、 H + 、 CuCl (1) 步骤 Ⅰ 中发生了多个反应,其 Cu(NH 3 ) (2) 步骤 Ⅳ 需控制 pH 为 1~2 , 80℃ 下进行,加热温度不能过高的原因是 __________ 。 (3) 步骤 Ⅴ 目的是制备纯净的硫酸铜晶体,具体步骤是 80℃ 下蒸发浓缩、 __________ 。步骤 Ⅵ 在下列装置 ( 夹持及加热装置已省略 ) 中进行。 (4) 装置 c 中搅拌的目的是: ①加快反应速率,② __________ 。 (5) 实验结束后,制得的 CuI 固体过滤后用装置 d 所得溶液来洗涤,目的是 __________ ,然后再用无水乙醇洗涤。 |
|
| 91. | 详细信息 |
|
(1) 某溶液中可能含有 Ag + 、 Fe 3+ 、 K + 、 Ba 2+ 、 ①加入过量的稀盐酸,有白色沉淀生成; ②过滤,向滤液中加入过量的稀硫酸,又有白色沉淀生成; ③过滤,取少量滤液,滴入 2 滴 KSCN 溶液,没有明显的现象出现; ④另取少量步骤③中的滤液,加入 NaOH 溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。 根据实验现象回答:待测液中一定含有 ___ 离子;一定不含有 ___ 离子;还有 ___ 离子不能确定是否存在。 (2) 我国最早记载丹砂的药用价值和炼制方法。为了使人们重视丹砂,我国曾发行面值为 10 分的丹砂邮票。汞单质及其化合物在工业生产和科学研究上有着广泛用途,丹砂炼汞的反应原理包括以下两个反应: 反应 I : HgS+O 2 反应 II : 4HgS+4CaO ①反应 I 中,还原产物是 _____ 。 ②反应 I 生成 11.2LSO 2 ( 标准状况下,则转移电子数为 ) _____ N A 。 ③反应 II 中, HgS 是 ______ ( 填 “ 氧化剂 ”“ 还原剂 ” 或 “ 既是氧化剂,也是还原剂 ”) ,请用双线桥法标出反应 Ⅱ中电子转移的方向和数目 _____ 。 |
|
| 92. | 详细信息 |
|
大多数植物不能从空气中摄取氮,农作物生长需要通过合成氨,进行人工固氮。合成氨的某种催化剂 P ,主要成分为二价铁和三价铁的氧化物按一定比例形成的混合物。 (1) 铁、氧的物质的量之比为 (2) 兴趣小组查阅相关资料,发现该合成氨催化剂活性最高时,催化剂 P 中 (3) 兴趣小组发现以 (4) |
|
| 93. | 详细信息 |
|
请回答以下问题: (1) 氢化钠 (NaH) 为白色晶体,其中 (2) 在 3BrF 3 +5H 2 O=HBrO 3 +Br 2 +9HF+O 2 ↑ 的反应中, 3mol 的 BrF 3 参加反应时,被 H 2 O 所还原的 BrF 3 的物质的量是 ___________ 。 (3) 已知砒霜 As 2 O 3 与 Zn 可以发生如下反应: As 2 O 3 +6Zn+6H 2 SO 4 =2AsH 3 ↑+6ZnSO 4 +3H 2 O ①请用双线桥法标出电子转移的方向和数目 ___________ 。 ②若生成 0.2molAsH 3 ,则转移的电子数为 ___________ 。 (4) 氧化氯 (ClO 2 ) 是一种在水处理等方面有广泛应用的高效安全消毒剂,制备 ClO 2 有下列两种方法: 方法一: 2NaClO 3 +4HCl=2ClO 2 ↑+Cl 2 ↑+2NaCl+2H 2 O 方法二: 2NaClO 3 +H 2 O 2 +H 2 SO 4 =2ClO 2 ↑+O 2 ↑+Na 2 SO 4 +2H 2 O ①方法一中氧化剂与还原剂的物质的量之比为 ___________ ; ②若两种方法制备得到相同条件下相同体积的 ClO 2 气体,则两方法中消耗的还原剂质量之比为 ___________ ; ③ Cl 2 与 ClO 2 均用作水处理剂,若它们中的氯元素均被还原为 (5) 配平反应方程式 ( 答题卡上写出完整的化学方程式 ) ___________________ 。 ______Al+_______NaNO 3 +_____H 2 O=____Al(OH) 3 +____N 2 ↑+____NaAlO 2 |
|
| 94. | 详细信息 |
|
工业上采用向 ① ② 已知:反应 ①中 请计算: (1) 反应 ①中,氧化剂与还原剂的物质的量之比为 ___________ 。 (2) 要得到 |
|
| 95. | 详细信息 |
|
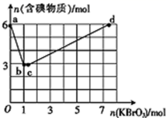
现向含 6 mol KI 的硫酸溶液中逐滴加入 KBrO 3 溶液,整个过程中含碘物质的物质的量与所加入 KBrO 3 的物质的量的关系如图所示,请回答下列问题: (1) 在 a→b 的反应过程中,其中的氧化剂为 _______ ,被氧化的元素为 _______ 。 (2) 已知 b→c 过程中,仅有溴元素发生化合价变化,写出并配平该反应离子方程式 _______ ; (3) 已知 c→d 发生反应: 2BrO |
|
| 96. | 详细信息 |
|
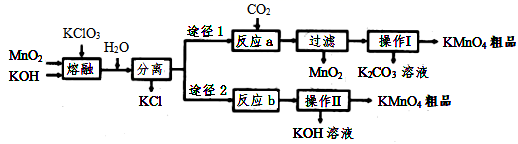
高锰酸钾是中学化学常用的试剂。主要用于防腐、化工、制药等。实验室模拟工业上用软锰矿制备高锰酸钾的流程如下: (1) 实验室熔融二氧化锰、氧氧化钾、氯酸钾时应选择哪一种仪器 _______ a. 普通玻璃坩埚 b. 石英坩埚 c. 陶瓷坩埚 d. 铁坩埚 (2) 第一步熔融时生成 K 2 MnO 4 的化学方程式: _______ (3) 操作 Ⅰ中根据 KMnO 4 和 K 2 CO 3 两物质在 _______ ( 填性质 ) 上的差异,采用浓缩结晶、趁热过滤得到 KMnO 4 。趁热过滤的原因是 _______ (4)KMnO 4 常用在实验室制取氧气,其产物常做电池材料,其中碱性电池锌 — 锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO 2 (s)+H 2 O(l)=Zn(OH) 2 (s)+Mn 2 O 3 (s) 。电池工作时,锌做 _______ 极,电池正极的电极反应式为 _______ 外电路中每通过 0.2mol 电子,锌的质量理论上减小 _______ g (5)KMnO 4 稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的 _______ ( 填标号 ) a. 双氧水 b.84 消液 (NaClO 溶液 ) c.75 %酒精 |
|
| 97. | 详细信息 |
|
焦亚硫酸钠 (1) 利用烟道气中的 资料:当 ①焦亚硫酸钠中硫元素的化合价为 _______ ,常温下焦亚硫酸钠溶于水形成的溶液显 _______ 性 ( 填 “ 酸 ” 、 “ 中 ” 或 “ 碱 ”) 。 ②控制Ⅰ中反应结束的方法是测定溶液的 pH ,当 ③Ⅲ中发生反应的化学方程式有 _______ 。 (2) 研究表明,焦亚硫酸钠处理含铬 (VI) 废水较其他方法效果好,处理费用低。其工艺流程如图: ①加硫酸调废水 pH 至 2.5 ,可增强 ②石灰乳的作用为 _______ 。 |
|
| 98. | 详细信息 |
|
SCR 催化剂是工业上广泛应用的燃煤烟气脱硝催化剂,其主要成分为 TiO 2 、 V 2 O 5 ,以及少量 SiO 2 、 CaO 、 Al 2 O 3 、 Fe 2 O 3 等。一种从废 SCR 催化剂中回收钨的工艺如下: 回答下列问题 (1) “酸浸还原”中 V 2 O 5 转化成可溶于水的 VOC 2 O 4 , VOC 2 O 4 中 V 的化合价是 ___________ ,该反应的化学方程式为 ___________ 。可用浓盐酸代替草酸,但缺点是 ___________ 。 (2) “碱浸”时 WO 3 转化为 WO (3) “试剂 a ”可选用 ___________ ( 选填 “盐酸”、“氢氧化钠”或“氨水” ) 。 “滤渣”的主要成分是 ___________ 。 (4) 常温下 (5) “熔融电解”过程中阴极反应为 WO |
|
| 99. | 详细信息 |
|
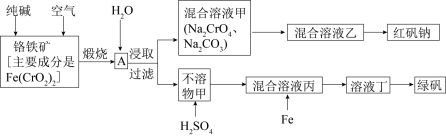
硫酸亚铁晶体俗称绿矾 (FeSO 4 • 7H 2 O) ,重铬酸钠晶体俗称红矾钠 (Na 2 Cr 2 O 7 ·2H 2 O) ,它们都是重要的化工产品。工业上以铬铁矿主要成分是 请回答下列问题: (1) 已知 Fe(CrO 2 ) 2 中铬元素的化合价为 +3 价,则 Fe(CrO 2 ) 中铁元素的化合价为 _______ 。 (2) 化学上可将某些盐写成氧化物的形式,如 Na 2 SiO 3 写成 Na 2 O·SiO 2 ,则 Fe(CrO 2 ) 2 可写成 _______ 。 ( 填化学式 ) (3) 煅烧铬铁矿时,矿石中的 Fe(CrO 2 ) 2 转变成可溶于水的 Na 2 CrO 4 ,反应的化学方程式: 4Fe(CrO 2 ) 2 +8Na 2 CO 3 +7O 2 ①该反应中还原剂与氧化剂的物质的量之比为 _______ 。 ②为了加快该反应的反应速率,可采取的措施是 _______ ( 填一种即可 ) 。 (4) 己知 ①往混合溶液甲中加入硫酸必须适量的原因是 _______ 。 ②混合溶液乙中溶质的化学式为 _______ (5) 从溶液丁到绿巩的实验操作为蒸发浓缩、 _______ 、过滤、洗涤、干燥。 |
|
| 100. | 详细信息 |
|
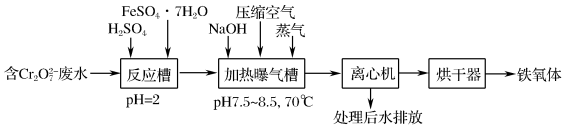
Cr( Ⅵ ) 对 A 体具有致癌、致突变作用。铁氧体法 ( 铁氧体是组成类似于 Fe 3 O 4 的复合氧化物,其中部分 Fe( Ⅲ ) 可被 Cr( Ⅲ ) 等所代换 ) 是目前处理 Cr( Ⅵ ) 废水的常见方法之一,其工艺流程如下: (1)Cr( Ⅵ ) 包括 CrO ①转化反应: 2CrO ②取某 Cr( Ⅵ ) 废水 ( 只含 CrO (2) 铁氧体法处理含 Cr 2 O ① “ 反应槽 ” 中发生反应的离子方程式为 ______ 。 ②在 “ 加热曝气槽 ” 中通入压缩空气的目的是 ______ 。 |
|