2017зҰҸе»әд№қе№ҙзә§дёӢеӯҰжңҹдәәж•ҷзүҲеҲқдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁеҜҢеҗ«иӣӢзҷҪиҙЁзҡ„жҳҜпјҲВ В В пјү A.йҰ’еӨҙВ В В В В B.зүӣеҘ¶В В В В В C.еҘ¶жІ№В В В В В В D.иҸ иҸң
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жқҗж–ҷдёҚеұһдәҺжңүжңәеҗҲжҲҗжқҗж–ҷзҡ„жҳҜпјҲВ В В пјү A.еЎ‘ж–ҷиўӢВ В В В В B.ж¶Өзә¶В В В В В C.иҡ•дёқВ В В В В В D.ж©Ўиғ¶жүӢеҘ—
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
зўій…ёй’ жҳҜйҮҚиҰҒзҡ„еҢ–е·ҘеҺҹж–ҷпјҢе…¶дҝ—з§°дёәпјҲВ В В пјү A.е°ҸиӢҸжү“В В В В В B.зәҜзўұВ В В В В C.зғ§зўұВ В В В В D.зҒ«зўұ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–иӮҘеұһдәҺеӨҚеҗҲиӮҘж–ҷзҡ„жҳҜпјҲВ В В пјү A.KNO3В В В В В B.KClВ В В В В C.Ca(H2PO4)2В В В В В В D.NH4NO3
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ | |||||||||
|
В зІ—зӣҗжҸҗзәҜе®һйӘҢе’Ңй…ҚеҲ¶дёҖе®ҡжә¶иҙЁиҙЁйҮҸеҲҶж•°зҡ„ж°ҜеҢ–й’ жә¶ж¶Іе®һйӘҢдёӯпјҢдёӢеҲ—ж“ҚдҪңжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
|
||||||||||
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
ж–°иЈ…дҝ®жҲҝе®ӨеҶ…еӯҳеңЁз”ІйҶӣпјҲCH2OпјүгҖҒиӢҜпјҲC6H6пјүзӯүжңүе®ізү©иҙЁпјҺдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A.з”ІйҶӣеҲҶеӯҗдёӯеҗ«жңүж°ҙеҲҶеӯҗВ В В В В В В В В B.иӢҜдёӯзўіе…ғзҙ дёҺж°ўе…ғзҙ зҡ„иҙЁйҮҸжҜ”дёә1пјҡ1 C.з”ІйҶӣдёӯзўіе…ғзҙ иҙЁйҮҸеҲҶж•°дёә40%В В В В D.з”ІйҶӣе’ҢиӢҜйғҪеұһдәҺж— жңәеҢ–еҗҲзү©
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁеҸіеӣҫиҜ•з®ЎйҮҢзҡ„ж°ҙдёӯеҠ е…ҘдёӢиҝ°жҹҗз§Қзү©иҙЁеҗҺпјҢеҺҹжқҘUеһӢВ В з®ЎеҶ…еңЁеҗҢдёҖж°ҙе№ідёҠзҡ„зәўеўЁж°ҙпјҢеҸіиҫ№ж¶ІйқўйҷҚдҪҺдәҶдәӣпјҢе·Ұ иҫ№ж¶ІйқўдёҠеҚҮдәҶдәӣпјҢеҲҷеҠ е…Ҙзҡ„зү©иҙЁжҳҜпјҲВ В В пјү A.зЎқй…ёй“өгҖҖВ В B.з”ҹзҹізҒ°гҖҖВ В C.йЈҹзӣҗВ В В В В D.зғ§зўұ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁpHиҜ•зәёжөӢеҫ—家еәӯеёёз”Ёжҙ—ж¶ӨеүӮзҡ„pHеҰӮдёӢиЎЁжүҖзӨәпјҡ
еңЁжІЎжңүйҷӨй”ҲеүӮзҡ„жғ…еҶөдёӢпјҢеҸҜд»Ҙз”ЁжқҘд»ЈжӣҝйҷӨй”ҲеүӮзҡ„жҳҜпјҲВ В В пјү A.еҺЁжҲҝжё…жҙҒеүӮгҖҖВ B.жҙ—иЎЈж¶І гҖҖ C.жҙ—еҸ‘зІҫгҖҖВ D.еҺ•жүҖжё…жҙҒеүӮ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗиғҪеңЁpHпјқ13зҡ„ж°ҙжә¶ж¶ІдёӯеӨ§йҮҸе…ұеӯҳзҡ„жҳҜпјҲВ В В пјү В В В AпјҺSO42пјҚгҖҒClпјҚгҖҒNaпјӢгҖҒHпјӢВ В В В В В В В В В В В В В BпјҺKпјӢгҖҒSO42пјҚгҖҒCu2пјӢгҖҒNO3пјҚ CпјҺClпјҚгҖҒKпјӢгҖҒSO42пјҚгҖҒNaпјӢВ В В В В В В В В В DпјҺCa2пјӢгҖҒClпјҚгҖҒCO32пјҚгҖҒNaпјӢ
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
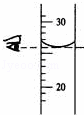
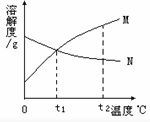
В еҰӮеҸіеӣҫжҳҜMгҖҒNдёӨз§Қзү©иҙЁзҡ„жә¶и§ЈеәҰжӣІзәҝпјҢз”ұжә¶и§ЈеәҰжӣІзәҝеҫ—еҮәд»ҘдёӢеҮ жқЎдҝЎжҒҜпјҢдҪ и®ӨдёәжӯЈзЎ®зҡ„жҳҜпјҲ В В В пјү AпјҺt1в„ғж—¶пјҢMгҖҒNдёӨзү©иҙЁжә¶ж¶Іжә¶иҙЁиҙЁйҮҸеҲҶж•°зӣёзӯү BпјҺз”ұt1в„ғеҚҮжё©еҲ°t2в„ғж—¶пјҢNзү©иҙЁжә¶ж¶Іжә¶иҙЁиҙЁйҮҸеҲҶж•°дёҚеҸҳ CпјҺMзү©иҙЁзҡ„жә¶и§ЈеәҰеӨ§дәҺNзү©иҙЁзҡ„жә¶и§ЈеәҰВ В В В В В DпјҺNзү©иҙЁзҡ„жә¶и§ЈеәҰйҡҸжё©еәҰзҡ„еҚҮй«ҳиҖҢйҷҚдҪҺ
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
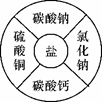
иҜ·еңЁHгҖҒOгҖҒSгҖҒCaдёӯпјҢйҖүжӢ©йҖӮеҪ“е…ғзҙ пјҢз»„жҲҗз¬ҰеҗҲдёӢеҲ—иҰҒжұӮзҡ„зү©иҙЁпјҢеҗ„еҶҷдёҖдёӘеҢ–еӯҰејҸгҖӮ В В пјҲ1пјүж°§еҢ–зү©_ _____пјӣпјҲ2пјүй…ё_______пјӣпјҲ3пјүзўұ_______пјӣпјҲ4пјүзӣҗ_______гҖӮ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
вҖңй“ҒгҖҒй“ңгҖҒй“қгҖҒй”ҢвҖқжҳҜз”ҹжҙ»дёӯеёёи§Ғзҡ„йҮ‘еұһ пјҲ1пјүдәәдҪ“зјәгҖҖВ В гҖҖе…ғзҙ дјҡеј•иө·йЈҹж¬ІдёҚжҢҜпјҢз”ҹй•ҝиҝҹзј“пјҢеҸ‘иӮІдёҚиүҜпјӣ пјҲ2пјүй“ңдёқеёёз”ЁжқҘдҪңз”өзәҝпјҢдё»иҰҒжҳҜеҲ©з”Ёй“ңзҡ„гҖҖВ В В гҖҖжҖ§пјӣ пјҲ3пјүй“ҒеңЁВ В В В В В (еЎ«вҖңе№ІзҮҘвҖқжҲ–вҖңжҪ®ж№ҝвҖқ)зҡ„з©әж°”дёӯжҳ“з”ҹй”ҲпјҢй“Ғй”ҲиӢҘдёҚеҸҠж—¶йҷӨеҺ»дјҡеҠ еҝ«еҶ…йғЁй“Ғзҡ„и…җиҡҖйҖҹеәҰпјҢжҲ‘们еҸҜз”ЁзЁҖзӣҗй…ёйҷӨеҺ»й“Ғй”ҲпјҢеҶҷеҮәиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ пјҲ4пјүеҸӘз”ЁдёҖз§ҚиҜ•еүӮе°ұиғҪдёҖж¬ЎжҖ§еҲӨж–ӯйҮ‘еұһй“ңгҖҒй“қгҖҒй”Ңзҡ„жҙ»еҠЁжҖ§йЎәеәҸпјҢиҝҷз§ҚиҜ•еүӮжҳҜгҖҖгҖҖгҖӮ AпјҺCuSO4жә¶ж¶ІВ В В BпјҺAl2(SO4)3жә¶ж¶ІВ В В В CпјҺZnSO4жә¶ж¶І
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ій…ё(HCOOH)жҳҜдёҖз§Қжңүжңәй…ёпјҢе®ғзҡ„й…ёжҖ§жҜ”зўій…ёејәпјҢжҜ”зӣҗй…ёејұпјҢжңүеҲәжҝҖжҖ§ж°”е‘іе’Ңиҫғејәзҡ„и…җиҡҖжҖ§гҖӮиҡӮиҡҒгҖҒиҡҠиҷ«еҸ®е’¬ж—¶дјҡеҲҶжіҢеҮәз”Ій…ё,жүҖд»Ҙз”Ій…ёеҸҲдҝ—з§°иҡҒй…ёгҖӮ пјҲ1пјүдәәиў«иҡҠиҷ«еҸ®е’¬еҗҺдјҡз—’з—ӣпјҢеҸҜд»Ҙж¶ӮжҠ№дёӢеҲ—зү©иҙЁдёӯзҡ„гҖҖгҖҖгҖҖгҖҖ(еЎ«еәҸеҸ·)ж¶ҲйҷӨгҖӮ В В В В В в‘ зЁҖзӣҗй…ёгҖҖ В В в‘ЎйЈҹйҶӢгҖҖВ В В в‘ўиӮҘзҡӮж°ҙгҖҖВ в‘ЈйЈҹзӣҗж°ҙ пјҲ2пјүй…ёе…·жңүзӣёдјјзҡ„еҢ–еӯҰжҖ§иҙЁпјҢжҳҜеӣ дёәй…ёжә¶ж¶ІдёӯйғҪеҗ«жңүзӣёеҗҢзҡ„В В В В (еЎ«зҰ»еӯҗз¬ҰеҸ·)пјҢжүҖд»Ҙз”Ій…ёд№ҹиғҪдҪҝзҙ«иүІзҡ„зҹіи•Ҡжә¶ж¶ІеҸҳВ В В В В В В пјӣ пјҲ3пјүзҷҪиҡӮиҡҒйҷӨдәҶдјҡиӣҖиҡҖжңЁеӨҙеӨ–пјҢе®ғеҲҶжіҢзҡ„иҡҒй…ёиҝҳдјҡи…җиҡҖеҫҲеӨҡе»әзӯ‘жқҗж–ҷпјҢдёӢеҲ—е»әзӯ‘жқҗж–ҷдёҚе®№жҳ“иў«иҡҒй…ёи…җиҡҖзҡ„жҳҜгҖҖгҖҖВ гҖҖгҖҖгҖҖ(еЎ«еӯ—жҜҚ)гҖӮ В В В A.й“ңж ҸжқҶгҖҖВ B.й’ўзӯӢВ В В C.еӨ§зҗҶзҹіВ В D.зҺ»з’ғ пјҲ4пјүдҪҝз”Ёжө“зЎ«й…ёдҪңеӮ¬еҢ–еүӮпјҢеңЁеҠ зғӯзҡ„жқЎд»¶дёӢпјҢз”Ій…ёеҲҶи§Јеҫ—еҲ°дёҖз§Қеёёи§Ғзҡ„жңүжҜ’ж°”дҪ“е’ҢеҸҰдёҖз§Қж°§еҢ–зү©пјҢе…¶еҢ–еӯҰж–№зЁӢејҸдёәгҖҖВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
(1)еңЁзўій…ёй’ жә¶ж¶Ідёӯж»ҙе…Ҙж°ҜеҢ–й’ҷжә¶ж¶ІпјҢзҺ°иұЎжҳҜ_____________гҖӮ (2)зўій…ёй’ҷгҖҒзўій…ёй’ еқҮиғҪдёҺзЁҖзӣҗй…ёеҸҚеә”з”ҹжҲҗCO2пјҢжҳҜеӣ дёәзўій…ёй’ҷгҖҒ зўій…ёй’ дёӯеқҮеҗ«жңү___В _____(еЎ«зҰ»еӯҗз¬ҰеҸ·)гҖӮ (3)зЎ«й…ёй“ңжә¶ж¶ІдёҺж°ўж°§еҢ–й’ жә¶ж¶ІиғҪеҸ‘з”ҹеҸҚеә”пјҢиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә_______В В В В В В В В В В _____В В В ______пјӣ зЎ«й…ёй“ңжә¶ж¶ІдёҺж°ҜеҢ–й’ жә¶ж¶ІдёҚиғҪеҸҚеә”пјҢе…¶зҗҶз”ұжҳҜ_______В _____________гҖӮ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
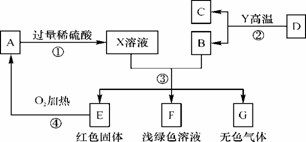
д»ҘдёӢAгҖҒBгҖҒCгҖҒDгҖҒEгҖҒFгҖҒGдёәеёёи§Ғзҡ„зү©иҙЁпјҢе…¶дёӯBгҖҒEгҖҒGеұһдәҺеҚ•иҙЁпјҢеҸҚеә”в‘ЎжҳҜзӮјй“Ғе·Ҙдёҡдёӯзҡ„дё»иҰҒеҸҚеә”пјҢе®ғ们д№Ӣй—ҙзҡ„зӣёдә’иҪ¬еҢ–е…ізі»еҰӮдёӢеӣҫжүҖзӨәпјҡ
(1)зү©иҙЁAзҡ„еҢ–еӯҰејҸжҳҜ____В _ ___пјӣеҶҷеҮәеҸҚеә”в‘Јзҡ„еҹәжң¬еҸҚеә”зұ»еһӢ___В В _____гҖӮ (2)еҶҷеҮәеҸҚеә”в‘Ўзҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ_______________В В В В В В В В _______________гҖӮ (3)еҶҷеҮәеҸҚеә”в‘ўдёӯз”ҹжҲҗзәўиүІеӣәдҪ“Eзҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ_______________________гҖӮ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||||||||||||
|
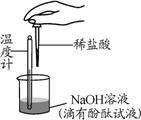
зә§еҗҢеӯҰејҖеұ•еҰӮеҸіеӣҫжүҖзӨәзӣёе…ізҡ„е®һйӘҢгҖӮдёӢйқўжҳҜдёӨдёӘе°Ҹз»„зҡ„е®һВ йӘҢи®°еҪ•дёҺеҲҶжһҗгҖӮиҜ·ж №жҚ®иҰҒжұӮеӣһзӯ”й—®йўҳпјҡ пјҲ1пјүе®Өжё©дёӢпјҢз”Із»„еҗҢеӯҰеҫҖдёҖе®ҡдҪ“з§Ҝ10%зҡ„ж°ўж°§еҢ–й’ жә¶ж¶Іж ·е“Ғдёӯж»ҙеҠ 10%зҡ„зӣҗй…ёпјҢеҸҚеә”дёӯжә¶ж¶Іжё©еәҰзҡ„еҸҳеҢ–и®°еҪ•еҰӮдёӢпјҡ
ж №жҚ®дёҠиЎЁж•°жҚ®еҲҶжһҗпјҡ в‘ еҪ“еҠ е…Ҙзӣҗй…ёдҪ“з§ҜдёәВ В В В В В mLж—¶пјҢиЎЁжҳҺNaOHдёҺHClжҒ°еҘҪе®Ңе…ЁеҸҚеә”гҖӮжӯӨеҲӨж–ӯзҡ„дҫқжҚ®жҳҜгҖҖВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖҖгҖӮ в‘ЎеҪ“еҠ е…Ҙ6 mLзӣҗй…ёж—¶пјҢзғ§жқҜдёӯжә¶ж¶Ід»Қ然е‘ҲзәўиүІпјҢиҜҘжә¶ж¶Ідёӯеҗ«жңүзҡ„жә¶иҙЁжңүй…ҡй…һе’ҢВ В гҖҖВ В В В В В В В В В В В В В В В гҖӮ В (2) иҜ·дҪ еҸӮдёҺе®ҢжҲҗд№ҷз»„еҗҢеӯҰзҡ„е®һйӘҢи®°еҪ•дёҺеҲҶжһҗгҖӮ
|
||||||||||||||||||||||||||||||||
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗеҗҢеӯҰеңЁе®һйӘҢе®ӨеҸ–9.8gжңӘзҹҘжө“еәҰзҡ„зЎ«й…ёжә¶ж¶ІдәҺзғ§жқҜдёӯпјҢж»ҙеҠ дёҖе®ҡжә¶иҙЁиҙЁйҮҸеҲҶж•°зҡ„ж°ҜеҢ–й’Ўжә¶ж¶ІпјҢзӣҙеҲ°дёҚеҶҚдә§з”ҹжІүж·ҖдёәжӯўпјҢе…ұз”ЁеҺ»10gж°ҜеҢ–й’Ўжә¶ж¶ІпјҢиҝҮж»ӨеҗҺжүҖеҫ—ж»Өж¶ІиҙЁйҮҸдёә17.47gпјҺ пјҲеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡH2SO4+BaCl2в•җBaSO4вҶ“+2HClпјү
|
|
- 2018еұҠеҲқдёүдёҠеҶҢ12жңҲжңҲиҖғеҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲпјҲе®үеҫҪзңҒ马йһҚеұұеёӮе»әдёӯеӯҰж Ўпјү
- еҲқдёүеүҚеҚҠжңҹжңҹжң«еҢ–еӯҰйўҳеҗҢжӯҘи®ӯз»ғе…Қиҙ№иҜ•еҚ·пјҲ2019-2020е№ҙе®үеҫҪзңҒе®ЈеҹҺеёӮпјү
- 2017-2018е№ҙеҲқдёүеүҚеҚҠжңҹжңҹжң«еҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲпјҲжІіеҚ—зңҒеҚ—йҳіеёӮж–№еҹҺеҺҝпјү
- жІіеҚ—зңҒж–°д№ЎеёӮй•ҝеһЈеёӮ2020-2021е№ҙеҲқдёүдёҠеҶҢжңҹжң«еҢ–еӯҰиҜ•еҚ·еңЁзәҝз»ғд№
- 2019еұҠд№қе№ҙзә§дёӢеҶҢдёӯиҖғжЁЎжӢҹиҒ”иҖғеҢ–еӯҰиҖғиҜ•е®Ңж•ҙзүҲпјҲж№–еҚ—зңҒй•ҝжІҷеёӮйӣ…е®һгҖҒеҢ—йӣ…гҖҒй•ҝйӣ…гҖҒжҳҺеҫ·еҚҺе…ҙзӯүж Ўпјү
- 2017е№ҙйҷ•иҘҝзңҒдёӯиҖғеҢ–еӯҰйқўеҜ№йқўеҚ·д№қе№ҙзә§дё“йўҳдәҢ
- еҶ…и’ҷеҸӨ2017е№ҙд№қе№ҙзә§еүҚеҚҠжңҹеҢ–еӯҰе…Қиҙ№жЈҖжөӢиҜ•еҚ·
- 2020е№ҙе№ҝдёңзңҒжё…иҝңеёӮжё…ж–°еҢәдёӯиҖғдё“йўҳдёғеҢ–еӯҰе®һйӘҢ