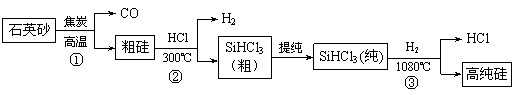2020四川高一上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
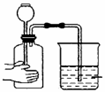
节日的夜晚,城市射灯在夜空中交织出五颜六色的光柱,这是因为空气中存在( ) A. 氧气 B. 氮气 C. 水蒸气 D. 胶体
|
|
| 2. | 详细信息 |
|
下列物质属于纯净物的是( ) A. 水玻璃 B. 明矾 C. 漂白粉 D. 氯水
|
|
| 3. | 详细信息 |
|
下列大小关系不正确的是( ) A.酸性:盐酸>碳酸>硅酸 B.稳定性:Ca(ClO)2>HClO C.硬度:镁铝合金>金属铝 D.溶解度:NaHCO3>Na2CO3
|
|
| 4. | 详细信息 |
|
下列各组离子,在酸性溶液中一定能够大量共存的是( ) A.Na+、Cl-、SO42-、HCO C.Cu2+、Al3+、Cl-、SO42- D.Fe3+、Na+、SCN-、Cl-
|
|
| 5. | 详细信息 |
|
《环境空气质量标准》将PM2.5纳入强制监测指标,迄今为止,中国空气污染物监测指标应包括:①二氧化硫、②一氧化碳、③二氧化氮、④可吸入颗粒物(PM10)、⑤PM2.5。上述5种检测物中,能形成酸雨的是( ) A.①③ B.①②③ C.④⑤ D.①②④⑤
|
|
| 6. | 详细信息 |
|
下列物品主要含氧化铝的是( ) A. 耐火坩埚 B. 砖瓦 C. 玛瑙手镯 D. 水晶镜片
|
|
| 7. | 详细信息 |
|
下列关于实验室保存药品的方法不正确的是( ) A.用带橡皮塞的试剂瓶保存烧碱溶液 B.过氧化钠密封保存在细口玻璃瓶中 C.金属钠保存在液体石蜡或煤油中 D.氯水保存在带磨口玻璃塞的棕色试剂瓶中
|
|
| 8. | 详细信息 | ||||||||||||
|
欲进行下列实验,其方案设计合理的是( )
|
|||||||||||||
| 9. | 详细信息 |
|
下列各组气体在常温下能共存,且均能用向上排空气法收集的是( ) A.NO和O2 B.H2和Cl2 C.SO2和O2 D.H2S和SO2
|
|
| 10. | 详细信息 |
|
将一小块钠投入到以下物质中,其中一种产生的现象与其余三种不同,这种物质是( ) A.水 B. 稀H2SO4 C.MgCl2溶液 D.BaCl2溶液
|
|
| 11. | 详细信息 | ||||
|
下列解释实验现象的反应方程式错误的是( ) A.切开的金属钠暴露在空气中,光亮表面逐渐变暗:2Na+O2==Na2O2 B.碳酸银加入稀硝酸中,有气泡产生:Ag2CO3+2H+==2Ag++CO2↑+H2O 光照 或受热
|
|||||
| 12. | 详细信息 |
|
用NA表示阿伏加德罗常数的值。下列叙述中正确的是( ) A.足量Na2O2和11.2 L CO2反应,转移电子数目为0.5NA B.1 mol SO2和O2的混合气体中含有的氧原子数为2NA C.常温常压下,17g OH—所含电子数为9NA D.5.6 g铁与7.1g氯气充分反应,转移电子数为0.3NA
|
|
| 13. | 详细信息 |
|
下列物质转化在给定条件下不能实现的是( ) A. S C. Fe
|
|
| 14. | 详细信息 |
|
下列各项操作中,会产生“先沉淀后溶解”现象的是( ) A.向CaCl2溶液中通入过量SO2 B.向Na2SiO3溶液中滴入过量盐酸 C.向沸水中滴加饱和FeCl3溶液 D.向AlCl3溶液中加入足量金属钠
|
|
| 15. | 详细信息 |
|
下列关于“燃烧”的说法错误的是( ) A. 燃烧一定伴有发光现象 B. 燃烧一定是氧化还原反应 C. 燃烧一定要有氧气参加 D. 氢气在氯气中燃烧产生苍白色火焰
|
|
| 16. | 详细信息 |
|
有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验: ① 将部分粉末加入水中,振荡,有白色沉淀生成; ② 向①的悬浊液中加入过量稀盐酸,白色沉淀消失,并有气泡产生; ③ 取少量②的溶液滴入AgNO3溶液,有白色沉淀生成。 下列关于白色粉末组成的判断正确的是( ) A.肯定含有CaCl2、K2CO3,可能含有Ba(NO3)2 B.肯定含有Ba(NO3)2、K2CO3,可能含有CaCl2 C.肯定含有K2CO3,至少含有Ba(NO3)2和CaCl2中的一种 D.Ba(NO3)2、CaCl2、K2CO3都存在
|
|
| 17. | 详细信息 |
|
下列现象或事实不能用同一原理解释的是( ) A.SO2既能使氯水褪色,又能使酸性KMnO4溶液褪色 B.Cl2、SO2分别通入品红溶液中,品红均褪色 C.食盐水和氯水中滴加AgNO3溶液均产生沉淀 D.稀盐酸和氯水中加入小块CaCO3均产生气泡
|
|
| 18. | 详细信息 |
|
泡沫灭火器利用NaHCO3遇酸性溶液发生反应产生CO2泡沫来灭火。泡沫灭火器中选用NaHCO3而不用Na2CO3的下列解释中,不合理的是( ) A. 产生等物质的量的CO2,NaHCO3消耗的H+少 B. 等质量的NaHCO3和Na2CO3与酸反应时前者产生CO2多 C. 两种固体遇酸都产生CO2,但NaHCO3比Na2CO3反应快些 D. NaHCO3在加热时易分解产生CO2,而Na2CO3不易分解
|
|
| 19. | 详细信息 |
|
几种物质在酸性溶液中的还原性强弱顺序如下:SO2>I->Fe2+>H2O2。据此判断下列反应不能发生的是( ) A. 2Fe3++SO2+2H2O==2Fe2++SO C. SO2+I2+2H2O==H2SO4+2HI D. 2Fe3++2I-==2Fe2++I2
|
|
| 20. | 详细信息 |
|
A. 若A是氯气,则E可能为铁 B. 若A是CuO,E是碳,则B为CO C. 若A是NaOH溶液,E是CO2,则B为NaHCO3 D. 若A是AlCl3溶液,E可能是NaOH溶液
|
|
| 21. | 详细信息 |
|
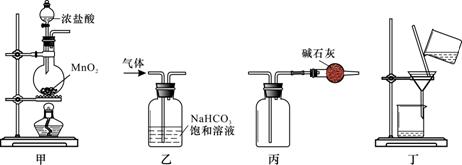
下列装置应用于实验室制取氯气并回收氯化锰溶液,不能达到实验目的的是( )
A.用装置甲制取氯气 B.用装置乙除去氯气中的少量氯化氢 C.用装置丙收集氯气并防止污染空气 D.用装置丁分离二氧化锰和氯化锰溶液
|
|
| 22. | 详细信息 |
|
在100mL1.0mol/L的AlCl3溶液中加入350mL 1.0mol/L的NaOH溶液充分反应后,得到沉淀的质量是( ) A. 3.9g B. 7.8g C. 15.6g D. 0g
|
|
| 23. | 详细信息 |
|
在体积相同的两个密闭容器中分别充满NO2、N2O4气体,当这两个容器内温度和气体密度都相等时,下列说法正确的是( ) A.两种气体的氧原子数相等 B.NO2比N2O4的质量小 C.两种气体的分子数相等 D.两种气体的压强相等
|
|
| 24. | 详细信息 |
|
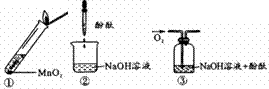
过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下
下列分析错误的是( ) A.过氧化钠与水反应产生的气体为O2 B.过氧化钠与水反应需要MnO2作催化剂 C.实验②、③证明使酚酞褪色的不是NaOH和O2 D.过氧化钠与水反应可能生成了具有漂白性的H2O2
|
|
| 25. | 详细信息 |
|
一只试管中NO、NO2、O2以不同的体积比混合,将试管倒立于一盛有足量水的水槽中,水能充满试管的是( ) A.1:1:2 B.9:6:1 C.8:4:7 D.4:2:3
|
|
| 26. | 详细信息 |
|
将SO2通入氯化钡溶液中无现象;若将SO2通入硝酸钡溶液中,有白色沉淀产生, 其化学反应方程式如下(未配平): SO2+ Ba(NO3)2+ H2O —— BaSO4↓+ HNO3+ NO↑ (1)配平上述化学反应方程式并用双线桥表示电子转移的方向和数目。 (2)该反应中, 发生氧化反应,氧化剂是 。氧化产物与还原产物的物质的量之比为 。 (3)当反应消耗二氧化硫19.2 g时,反应中转移电子数目为 ,生成NO的体积 为 (标准状况)。
|
|
| 27. | 详细信息 |
|
化学研究主要用的是实验方法,所以学习化学离不开实验。请回答: (1)在试管里注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以观察到试管中产生白色絮状沉淀,发生反应的离子方程式是____________________。生成的沉淀迅速变成灰绿色,最后变成红褐色,发生反应的化学方程式为____________________________。 (2)实验室在保存含Fe2+的溶液时,经常向其中加入铁粉,其目的是 。为了检验该溶液是否变质,应采用的实验操作及现象是 。 (3)除去铁粉中混有的铝粉应选用的试剂为 ,发生反应的离子方程式为 。 (4)将等体积的SO2与Cl2同时通入品红溶液中,可以看到的现象是 ,发生反应的离子方程式是 。
|
|
| 28. | 详细信息 |
|
实验室需要480 mL 0.1 mol·L-1的硫酸铜溶液,现按以下步骤进行配制: (1)配制主要步骤有:计算→称量→ →转移→ →定容→摇匀。 (2)计算需要胆矾(CuSO4·5H2O)的质量为 12.5g 。 (3)在该实验中要用到玻璃仪器除玻璃棒外还有_________ ,使用容量瓶前首先要 。 检查是否漏水 ①③④②⑤ (4)以下操作会导致所配溶液①②⑤⑥,,,,导致浓度偏高的是 。 ③ ①砝码生锈 ②容量瓶使用前用蒸馏水洗净后未烘干 ③烧杯中的溶液转移到容量瓶后,未用蒸馏水洗涤烧杯 ④定容时俯视观察液面 ⑤定容时不小心加水超过刻度线,用滴管吸出多余溶液 (5)所配溶液经测定密度为1.25g/mL,则该溶液中溶质的质量分数为______%
|
|
| 29. | 详细信息 |
|
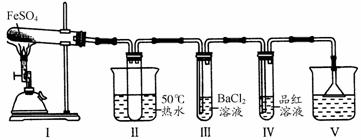
某自主学习小组用酒精喷灯加热FeSO4白色固体时,观察到白色固体变为红棕色,并产生气体,生成的气体是什么呢? 【提出假设】假设一:生成的气体中只有SO3; 假设二:生成的气体中只有SO2; 假设三:生成的气体中只有O2; 假设四…… 【思考交流】①FeSO4受热分解生成的红棕色固体的化学式为 ,从化学反应的质量守恒定律即可判断,假设 是错误的;从元素化合价升降和电子转移的观点即可判断,假设 是错误的;②你认为:气体生成物一定有 ,可能有 。 【设计实验,验证假设】自主学习小组的同学经讨论,设计了如下实验来验证FeSO4分解的气体产物。查阅资料可知:SO3的熔点是16.8℃,沸点是44.8℃;SO2的熔点是-76.1℃,沸点是-10℃。
(1)装置Ⅱ的试管中不装任何试剂,其作用是 ,试管浸泡在50℃的水浴中,目的是 。 (2)实验装置 Ⅲ 的实验现象为 ,装置 Ⅳ 用来检验 。 (3)装置Ⅴ的作用是防止尾气污染环境,烧杯中反应的离子方程式是 。
|
|
| 30. | 详细信息 |
|
(1)制备粗硅(反应①)的化学反应方程式为 。 (2)已知SiHCl3能与H2O强烈反应,在空气中易自燃。粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为 。 (3)H2还原SiHCl3过程中若混入O2,可能引起的后果是 ,反应③的化学方程式是 。 (4)整个生产过程中,可以循环利用的气体是 ,高纯硅的一种用途是 。
|
|
| 31. | 详细信息 |
|
有一包Na2CO3和Na2O2的混合物质量为17.0g,加入足量水后发生反应放出1.8 L气体(该条件下,气体的摩尔体积为24L/moL)。试计算(注意:无计算过程不给分): (1)原混合物中Na2O2的质量分数; (2)若用盐酸溶解原混合物,使得到的溶液呈中性,需要0.5mol/L的盐酸多少毫升?
|
|