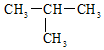2020北京高三上学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
下列化学用语或名称表述不正确的是( ) A. 葡萄糖的分子式:C6H12O6 B. HCl的电子式: C. D. 含有10个中子的氧原子可表示为:
|
|
| 2. | 详细信息 |
|
下列物质的用途利用了其氧化性的是( ) A. 漂粉精用于消毒游泳池水 B. SO2用于漂白纸浆 C. Na2S用于除去废水中的Hg2+ D. FeCl2溶液用于吸收Cl2
|
|
| 3. | 详细信息 |
|
下列各分子中,所有原子都满足最外层8电子结构的是 A. BF3 B. NCl3 C. H2O D. PCl5
|
|
| 4. | 详细信息 |
|
用NA表示阿伏加德罗常数,下列说法正确的是 A. 1 mol OH- 中含有9NA个电子 B. 28 g的CO气体中含有NA个氧原子 C. 1 L 1 mol/L的AlCl3溶液中含有NA个Al3+ D. 常温常压下11.2 L的甲烷气体含有的分子数为0.5NA
|
|
| 5. | 详细信息 |
|
表示下列反应的离子方程式正确的是( ) A. 铁溶于稀盐酸:2Fe+6H+=2Fe3++3H2↑ B. 氯化铝溶液中加过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ C. 碳酸氢铵溶液中加足量氢氧化钠并加热:NH4++OH﹣ D. 氯气通入水中,溶液呈酸性:Cl2+H2O⇌2H++Cl﹣+ClO﹣
|
|
| 6. | 详细信息 |
|
在pH =1且含有大量Fe2+和NH4+的溶液中,能大量存在的阴离子是 A. SO42- B. NO3- C. OH- D. HCO3-
|
|
| 7. | 详细信息 |
|
下列事实与碳、硅的非金属性强弱无关的是( ) A. CH4的热稳定性强于SiH4 B. H2CO3的酸性强于H2SiO3 C. CO2能溶于水生成碳酸,而SiO2却不溶于水 D. 碳、硅同主族,原子半径碳小于硅
|
|
| 8. | 详细信息 |
|
食品保鲜所用的“双吸剂”,是由还原铁粉、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水。下列分析不正确的是( ) A. “双吸剂”中的生石灰有吸水作用 B. “双吸剂”吸收氧气时,发生了原电池反应 C. 吸收氧气的过程中,铁作原电池的负极 D. 炭粉上发生的反应为:O2+4e﹣+4H+=2H2O
|
|
| 9. | 详细信息 |
|
已知33As、35Br位于同一周期,下列关系正确的是 A. 原子半径:As>Cl>P B. 热稳定性:HCl>AsH3>HBr C. 还原性:As3->S2->Cl- D. 酸性:H3AsO4>H2SO4>H3PO4
|
|
| 10. | 详细信息 | ||||||||
|
X、Y、Z、W四种短周期元素在周期表中相对位置如下表所示,Y是地壳中含量最高的元素。下列说法中不正确的是( )
A. Z的原子半径大于Y B. Y的非金属性强于W C. W的氧化物对应的水化物都是强酸 D. X、Z的最高价氧化物均可与NaOH溶液反应
|
|||||||||
| 11. | 详细信息 |
|
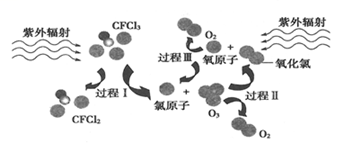
如图为氟利昂(如CFCl 3)破坏臭氧层的反应过程示意图,下列不正确的是
A. 过程Ⅰ中断裂极性键C-Cl键 B. 过程Ⅱ可表示为O3 + Cl =ClO + O2 C. 过程Ⅲ中O + O = O2是吸热过程 D. 上述过程说明氟利昂中氯原子是破坏O3的催化剂
|
|
| 12. | 详细信息 |
|
关于相同体积、相同 A. 室温时,由水电离出的 B. 用等浓度的 C. 均加水冲稀10倍后:盐酸的 D. 均加入足量镁粉,反应完全后产生
|
|
| 13. | 详细信息 |
|
白屈菜有止痛、止咳等功效,从其中提取的白屈菜酸的结构简式如图。 下列有关白屈菜酸的说法中,不正确的是( )
A. 分子式是C7H4O6 B. 能发生加成反应 C. 能发生水解反应 D. 能发生加聚反应
|
|
| 14. | 详细信息 |
|
通过卤素间
下列说法不正确的是 A. CCl4起到萃取、富集I2的作用 B. a中下层变无色,说明I2 转化为I- C. Ⅲ中发生反应的离子方程式为:Br2 + 2I-=== I2 + 2Br- D. 依据a、b中现象,可以证明Cl2的氧化性比 Br2强
|
|
| 15. | 详细信息 |
|
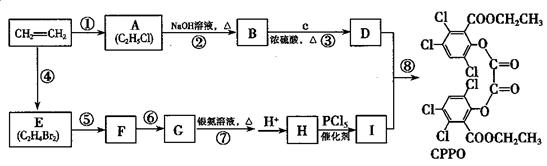
双草酸酯(CPPO)是冷光源发光材料的主要成分,合成某双草酸酯的路线设计如下:
已知: ① ② (1)B分子中含有的官能团名称是___。 (2)该CPPO结构中有___种不同化学环境的氢原子。 (3)反应④的化学方程式是___。 (4)在反应①~⑧中属于取代反应的是___。 (5)C的结构简式是___。 (6)写出F和H在一定条件下聚合生成高分子化合物的化学方程式___。 (7)资料显示:反应⑧有一定的限度,在D与I发生反应时加入有机碱三乙胺能提高目标产物的产率,其原因是___。
|
|
| 16. | 详细信息 | |||||||||
|
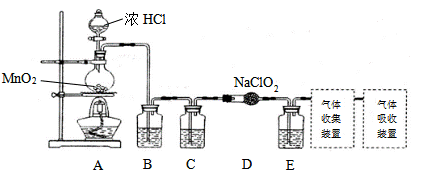
C1O2是常用的自来水消毒剂。 I.已知实验室可用亚氯酸钠固体与氯气反应制备ClO2:2NaClO2+C12 =2C1O2+2NaCl,装置如下图所示:
(1)圆底烧瓶内发生反应的化学方程式是:__________。 (2)已知常温常压下,ClO2和Cl2是气体,在下列溶剂中溶解性如下表所示:
B、C、E装置中的试剂依次是_________(填序号)。 a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.CCl4 e.饱和石灰水 II.使用C1O2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。 (3)Fe2+消除ClO2-的离子方程式为_______。 (4)实际向自来水中加入Fe2+的量要高于理论值,原因是(结合离子方程式解释)___________。
|
||||||||||
| 17. | 详细信息 |
|
海洋是一个巨大的化学资源宝库,从海水中可制取氯、溴、碘及其化工产品。 (1)氯的原子结构示意图是___。 (2)碘在元素周期表中的位置是___。 (3)向浓缩的海水中通入Cl2,可将Br﹣转化为Br2.该反应的离子方程式是___。 (4)用热空气将上述过程中产生的Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等;再将混合溶液用稀硫酸酸化得到Br2,得到Br2的离子方程式是___。
|
|
| 18. | 详细信息 | |||||||||||||||
|
在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
(1)已知t2>t1,HX的生成反应是___反应(填“吸热”或“放热”)。 (2)HX的电子式是___。 (3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是___。 (4)X2都能与H2反应生成HX,用原子结构解释原因:___。 (5)K的变化体现出X2化学性质的递变性,用原子结构解释原因:___,原子半径逐渐增大,得电子能力逐渐减弱。 (6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,___(选填字母)。 a.在相同条件下,平衡时X2的转化率逐渐降低 b.X2与H2反应的剧烈程度逐渐减弱 c.HX的还原性逐渐减弱 d.HX的稳定性逐渐减弱
|
||||||||||||||||
| 19. | 详细信息 |
|
黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼、煅烧后得到粗铜和炉渣,冶炼过程的主要反应有:
(1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是 。 (2)反应②中还原剂是 。 (3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。
① 炉渣碱浸时反应的离子方程式是 、 。 ② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是 ;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中 。
|
|
| 20. | 详细信息 |
|
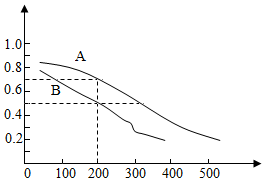
科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2。“气化炉”中主要反应有: C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol﹣1 CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41.2kJ•mol﹣1 (1)气化炉中CO2与C反应转化为CO,该反应的热化学方程式是___。 (2)用煤炭气合成甲醇的反应为CO(g)+2H2(g)⇌CH3OH(g)。在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如图所示。
①生成甲醇的反应为___反应(填“放热”或“吸热”)。 ②图中两条曲线分别表示压强为0.1MPa和5.0MPa下CO转化率随温度的变化,其中代表压强是5.0MPa的曲线是___(填“A”或“B”)。 ③在不改变反应物用量的前提下,为提高CO转化率可采取的措施有___(答出一种即可)。 ④压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是___。
|
|