湖北高二下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
某简易净水器如右图所示。下列说法中,正确的是 A.净水过程中发生了化学变化 B.该净水器能杀菌消毒 C.活性炭的主要作用是吸附杂质 D.净化后的水属于纯净物
|
|
| 2. | 详细信息 |
|
丙烯是一种常见的有机物。下列有关丙烯的化学用语中,不正确的是 A.实验式 CH2 B.结构简式 CH2=CHCH3 C.球棍模型:
|
|
| 3. | 详细信息 |
|
下列说法错误的是 A.有机物CH2=CH-CH3中碳的杂化类型有sp3 和sp2,其中有两个π键,7个σ键。 B.分子CO和N2的原子总数相同,价电子总数相等 C.Na+的电子排布式为1s22s22p6 D.CO2分子的构型为直线型
|
|
| 4. | 详细信息 |
|
25℃时,下列有关0.1 mol·L-1醋酸溶液的说法中,正确的是 A.pH = 1 B.c(H+) = c(CH3COO-) C.加入少量CH3COONa固体后,醋酸的电离程度减小 D.与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液显中性
|
|
| 5. | 详细信息 |
|
关于原子轨道的说法正确的是 A.凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体 B.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 C.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的 D.sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道
|
|
| 6. | 详细信息 |
|
下列离子方程式中,不正确的是 A.用NaOH溶液除去铝箔表面的氧化膜,Al2O3 + 2OH-=2AlO2-+ H2O B.向AlCl3溶液中加入过量氨水,Al3+ + 3NH3·H2O=Al(OH)3↓ + 3NH4+ C.用胃舒平(复方氢氧化铝)缓解胃酸(HCl)过多,OH-+ H+=H2O D.向污水中投放明矾,生成能凝聚悬浮物的胶体,Al3+ + 3H2O
|
|
| 7. | 详细信息 |
|
原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体具有结构相似的特征,下列各对粒子中,空间结构相似的是( ) ①CS2与NO2 ②CO2与N2O ③SO2与O3 ④PCl3与BF3 A.①②③ B.③④ C.②③④ D.②③
|
|
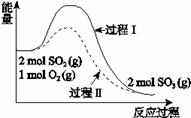
| 8. | 详细信息 |
|
A.a<0 B.过程II可能使用了催化剂 C.使用催化剂可以提高SO2的平衡转化率 D.反应物断键吸收能量之和小于生成物成键释放能量之和
|
|
| 9. | 详细信息 |
|
下列实验装置正确的是
|
|
| 10. | 详细信息 |
|
废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+ 完全转化为N2,该反应可表示为2NH4+ + 3ClO-=N2 + 3Cl-+ 2H+ + 3H2O。下列说法中,不正确的是 A.反应中氮元素被氧化,氯元素被还原 B.还原性 NH4+ > Cl- C.反应中每生成1 mol N2,转移6 mol电子 D.经此法处理过的废水可以直接排放
|
|
| 11. | 详细信息 |
|
下列推断正确的是( ) A.BF3是三角锥形分子 B.NH C.CH4分子中的4个C﹣H键都是氢原子的1s轨道与碳原子的p轨道形成的s﹣p σ键 D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s﹣sp3σ键
|
|
| 12. | 详细信息 |
|
以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀。根据上述实验事实,下列说法中,不正确的是 A.溶解度 MnS<PbS B.MnS存在沉淀溶解平衡 MnS(s) C.Cu2+转化为沉淀的原理为 MnS(s) + Cu2+(aq)=CuS(s) + Mn2+(aq) D.沉淀转化能用于除去溶液中的某些杂质离子
|
|
| 13. | 详细信息 |
|
下列各组微粒的空间构型相同的是 ①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥SiO44-和SO42- ⑦BF3和Al2Cl6 A.全部 B.除④⑥⑦以外 C.③④⑤⑥ D.②⑤⑥
|
|
| 14. | 详细信息 |
|
甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙十丁→沉淀;乙+丁→无色无味气体。则甲、乙、丙、丁四种溶液依次是 A.BaCl2 C.Na2CO3、 盐酸 、AgNO3、 BaCl2 D.AgNO3、盐酸、 BaCl2、Na2CO3
|
|
| 15. | 详细信息 |
|
已知:N2(g) + 3H2(g) A.X表示温度 B.L2>L1 C.反应速率 υ(M)>υ(N) D.平衡常数 K(M)>K(N)
|
|
| 16. | 详细信息 |
|
将气体a通入溶液b中,始终无明显变化的是
|
|
| 17. | 详细信息 | ||||||||||||||||
|
某同学使用石墨电极,在不同电压(x)下电解pH=1的FeCl2溶液,实验记录如下(a、b代表电压数值)
下列说法中,不正确的是 A.I中阳极附近的溶液可使KI淀粉试纸变蓝 B.II中出现黄色可能是因为Fe2+有还原性,在阳极放电产生Fe3+ C.由II中阳极现象可知,该电压下Cl-在阳极不放电 D.根据表中电压与阳极现象及产物的对应,可以看出离子是否放电与电压有关
|
|||||||||||||||||
| 18. | 详细信息 |
|
以下对核外电子运动状况的描述正确的是 A.同一原子中,2p,3p,4p能级的轨道依次增多 B.当碳原子的核外电子排布由 C.3p2表示3p能级有两个轨道 D.在同一能级上运动的电子,其运动状态可能相同
|
|
| 19. | 详细信息 |
|
共价键、离子键和范德瓦尔斯力都是微粒之间的不同作用力,下列含有上述两种结合力的是( ) ①Na2O2 ②SiO2 ③石墨 ④金刚石 ⑤NaCl ⑥白磷. A.①②④ B.①③⑥ C.②④⑥ D.③④⑤
|
|
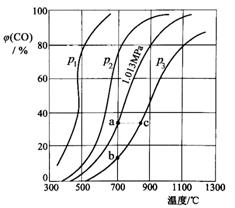
| 20. | 详细信息 | ||||||||||
|
合成氨工业涉及固体燃料的气化,需要研究CO2与CO
回答下列问题: (1)p1、p2、p3的大小关系是______________,欲提高C与CO2反应中CO2的平衡转化率,应采取的措施为 。图中a、b、c三点对应的平衡常数大小关系是_____ (2)900 ℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V,CO2的转化率为_________,该反应的平衡常数K= (3)将(2)中平衡体系温度降至640 ℃,压强降至0.1013 MPa,重新达到平衡后CO2的体积分数为50%。条件改变时,正反应和逆反应速率如何变化?____________,二者之间有何关系?___________。 (4)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生: CO(g)+3H2(g) CO(g)+H2O(g) ① 则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是__________ ② 已知298 K时相关化学键键能数据为:
则根据键能计算,∆H1= ,它与上述实测值差异较大的原因可能是 。
|
|||||||||||
| 21. | 详细信息 |
|
现有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,A原子的最外层电子排布式为1s1。B和D也属同一族,它们原子最外层的p能级与s能级的电子数之比是2∶1,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题: (1)以上这五种元素中,属于s区的是_________(填元素符号)。 (2)由这五种元素组成的一种化合物是_________________________(填化学式)。 (3)写出D元素基态原子的最外层电子排布图:____________________。 (4)元素电负性:B__________D,元素第一电离能:C________E。(填“>”“<”或“=”)
|
|
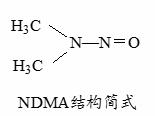
| 22. | 详细信息 |
|
亚硝酸盐与钴(Ⅲ)形成的一种配合物1Co(NH3)5NO2]Cl2的制备流程如下:
(1)Co2+基态核外电子排布式为 。 (2)配合物1Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为 (填元素符号);配离子 [Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为 。 (3)与NO2-互为等电子体的单质分子为 (写化学式)。 (4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为 。 (5)亚硝酸盐在水体中可转化为强致癌物亚硝胺,亚硝胺NDMA的结构简式如图所示,1molNDMA分子中含有σ键的数目为 mol。
|
|
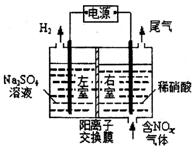
| 23. | 详细信息 |
|
电解原理在化学工业中有广泛应用。 (1)电解食盐水是氯碱工业的基础。目前比较先进的方法是阳离子交换膜法,电解示意图如图所示,图中的阳离子交
①图中A极要连接电源的______(填“正”或“负”)极。 ②精制饱和食盐水从图中_____位置补充,氢氧化钠溶液从图中____位置流出。(选填“a”、“b”、“c”、“d”、“e”或“f”) ③电解总反应的离子方程式是___________________________________。 (2)电解法处理含氮氧化物废气,可回收硝酸,具有较高的
①写出电解时NO2发生反应的电极反应________________________________。 ②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为__________mol。 (3)为了减缓钢制品的腐蚀,可以在钢制品的表面镀铝。电解液采用一种非水体系的室温熔融盐,由有机阳离子、A12C17-和AlCl4-组成。 ①钢制品应接电源的________极。 ②己知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应 ③若改用AlCl3水溶液作电解液,则阴极电极反应式为_______________________。
|
|
| 24. | 详细信息 |
|
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化的曲线是 填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1 m2 ( 选填“<”、“=”、“>”)。[来 (2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g) (3)某温度下Ksp[ Mg(OH)2] = 2×10 -11,若该温度下某MgSO4溶液里c(Mg 2+) =0.002 mol·L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于 ;该温度 (4)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。在分
|
|