2020山东高三上学期鲁科版高中化学月考试卷
| 1. | 详细信息 |
|
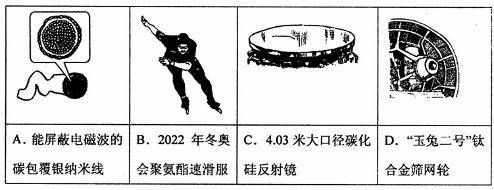
下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
| 2. | 详细信息 |
|
NA是阿伏加德罗常数的值,下列说法不正确的是 A.5.5g超重水(T2O)中含有的中子数目为3NA。 B.常温常压下,44 gCO2与足量过氧化钠反应转移电子的数目为NA C.常温常压下,42 gC2H4和C4H8混合气体中含有氢原子的数目为6NA D.0.1 L 05 mol·L-1CH3COOH溶液中含有H+的数目为0.2NA
|
|
| 3. | 详细信息 |
|
2012年,国际纯粹与应用化学联合会(IUPAC)宣布第116号元素命名为鉝(Livermorium),元素符号为Lv,以纪念劳伦斯利弗莫尔国家实验室(LLNL)对元素发现作出的贡献。下列有关叙述中不正确的是 ①Lv的非金属性比S强 ②Lv元素原子的内层电子共有110个 ③Lv是过渡金属元素 ④Lv元素原子的最高价氧化物对应的水化物为强酸 ⑤Lv元索的最高价氧化物的化学式为LvO3 A.①③④ B.①②④ C.③⑤ D.②⑤
|
|
| 4. | 详细信息 | |||||||||||||||
|
下列实验现象与实验操作不相匹配的是
|
||||||||||||||||
| 5. | 详细信息 |
|
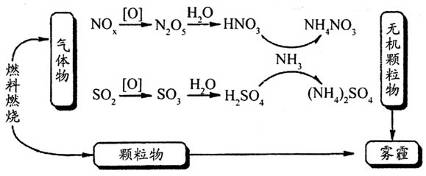
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述不正确的是
A.雾和霾的分散剂相同 B.雾霾中含有硝酸铵和硫酸铵 C.NH3是形成无机颗粒物的催化剂 D.雾霾的形成与过度施用氮肥有关
|
|
| 6. | 详细信息 |
|
第三周期的下列基态原子中,第一电离能最小的是 A.3s23p3 B.3s23p5 C.3s23p4 D.3s23p6
|
|
| 7. | 详细信息 |
|
能正确表示下列反应的离子方程式是 A.向硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O B.NH4HCO3溶液中加入过量的Ba(OH)2溶液: 2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- C.氢氧化亚铁溶于稀硝酸中:Fe(OH)2+2H+=Fe2++2H2O D.澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
|
|
| 8. | 详细信息 |
|
硫元素最常见和最稳定的一种同素异形体是黄色的正交α—型,1912年E.Beckmann由硫在碘中的冰点降低法测得它含有S8分子。1891年,M.R.Engel用浓盐酸和硫代硫酸盐的饱和溶液在0℃下作用首次制得了一种菱形的ε—硫,后来证明含有S6分子。下列说法正确的是 A.S6和S8分子都是由S原子组成,所以它们是一种物质 B.S6和S8分子分别与铁粉反应,所得产物不同 C.S6和S8分子分别与过量的氧气反应可以得到SO3 D.等质量的S6和S8分子分别与足量的KOH反应,消耗KOH的物质的量相同
|
|
| 9. | 详细信息 |
|
NH3、H2S等是极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子。根据上述实例可以推测出ABn型分子为非极性分子的经验规律是 A.分子中必须含有π键 B.在ABn分子中A原子没有孤对电子 C.在ABn分子中不能形成分子间氢键 D.分子中每个共价键的键长应相等
|
|
| 10. | 详细信息 |
|
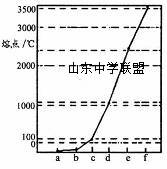
下图所示是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。下列说法不正确的是
A.e、f单质晶体熔化时克服的是共价键 B.d单质对应元素原子的电子排布式:1s22s22p63s23p2 C.b元素形成的气态氢化物易与水分子之间形成氢键 D.单质a、b、f对应的元素以原子个数比l:1:1形成的分子中含2个σ键,2个π键
|
|
| 11. | 详细信息 |
|
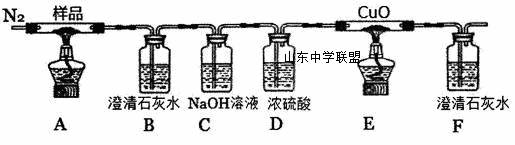
草酸亚铁(FeC2O4)可作为生产电池正极材料磷酸铁锂的原料, 下列说法不正确的是 A.实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO B.反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3 C.装置C的作用是除去混合气中的CO2 D.反应结束后,应熄灭A、E处酒精灯后,持续通入N2直至温度恢复至室温
|
|
| 12. | 详细信息 |
|
Fe与稀HNO3反应时,若两者消耗物质的量之比为4:10,且生成Fe(NO3)2,则反应中生成的还原产物可能是 A.N2 B.N2O C.NO D.NH4NO3
|
|
| 13. | 详细信息 |
|
今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,A、B、C、D为短周期主族元素,其中A、B、C在周期表中所处的位置如图所示,且它们的质子数之和为32。D元素原子的最外层电子数为次外层电子数的2倍。下列说法正确的是
A.原子半径:D>A>C B.常温常压下,B单质为固态 C.气态氢化物热稳定性:B>C D.C的最高价氧化物的水化物是强酸
|
|
| 14. | 详细信息 |
|
近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe—Sm—As—F—O组成的化台物。下列说法正确的是 A.元素As与N同族,可预测AsH3分子中As—H键的键角小于NH3中N—H键的键角 B.Fe成为阳离子时首先失去3d轨道电子 C.配合物Fe(CO)n可用作催化剂,Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=5 D.每个H2O分子最多可与两个H2O分子形成两个氢键
|
|
| 15. | 详细信息 |
|
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同;基态b原子的核外电子占据3个能级,且最高能级轨道为半充满状态;c的最外层电子数是内层电子数的3倍;d的原子序数是c的两倍;基态e原子3d轨道上有4个单电子。 回答下列问题: (1)b、c、d电负性最大的是____________(填元素符号)。 (2)b单质分子中σ键与π键的个数比为_________________。 (3)a与c可形成两种二元化合物分子,两种物质可以任意比互溶。其中一种不稳定,可分解产生c的单质,该化合物分子中的c原子的杂化方式为____________;这两种物质的互溶物中,存在的化学键有___________(填序号) ①极性共价键 ②非极性共价键 ③离子键 ④金属键 ⑤氢键 ⑥范德华力 (4)这些元素形成的含氧酸中,分子内中心原子的价层电子对数为4的酸是__________(填化学式,下同);酸根呈正三角形结构的酸是_________,试从两者结构特点判断该酸分子与酸根离子的稳定性:酸分子_______酸根离子(填“>”或“<”)。 (5)元素e在周期表中的位置是________区;e的一种常见氯化物中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在,结构式为
|
|
| 16. | 详细信息 |
|
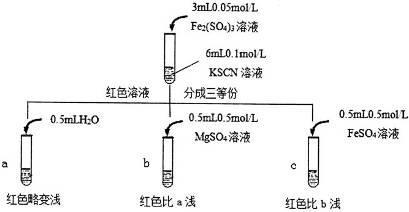
某实验小组对KSCN的性质进行探究,设计如下实验: (1)①用离子方程式表示实验Ⅰ溶液变红的原因__________________________________。 ②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KmnO4氧化为SO42-,并设计如图实验装置证实了猜想是成立的。
其中X溶液是______________,检验产物SO42-的操作及现象是_____________________。 (2)针对实验Ⅱ“红色明显变浅”,实验小组提出预测。 原因①:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使 原因②:SCN-可以与Fe2+反应生成无色络合离子,进一步使 已知:Mg2+与SCN-难络合,于是小组设计了如下实验:
由此推测,实验Ⅱ“红色明显变浅”的原因是____________________________。
|
|
| 17. | 详细信息 |
|
氮的氧化物和硫的氧化物是主要的大气污染物,烟气脱硫脱硝是环境治理的热点问题。回答下列问题: (1)目前柴油汽车都用尿素水解液消除汽车尾气中的NO,水解液中的NH3将NO还原为无害的物质。该反应中氧化剂与还原剂物质的量之比为__________________。 (2)KMnO4/CaCO3浆液可协同脱硫,在反应中MnO4-被还原为MnO42-。
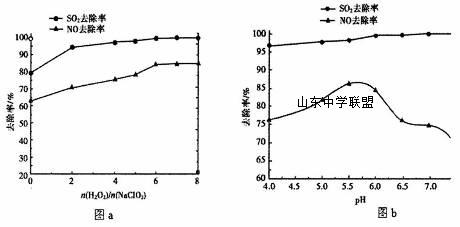
②加入CaCO3的作用是__________________________________________________。 ③KmnO4/CaCO3浆液中KMnO4与CaCO3最合适的物质的量之比为_______________。 (3)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液pH对脱硫脱硝的影响如下图所示: 从图a和图b中可知脱硫脱硝最佳条件是_______________________。图b中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因是________________________________________________。
|
|
| 18. | 详细信息 |
|
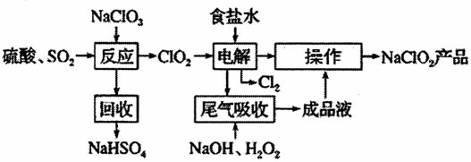
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,一种生产NaClO2的工艺如下:
已知:①ClO2是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaC1。同答下列问题: (1)最近科学家又在“反应”步骤的基础上研究出用H2C2O4代替SO2制备C1O2的新方法,该方法的化学方程式为_________________,该新方法最突出的优点是_______________。 (2)获得产品NaClO2的“操作”包括以下步骤: ①减压,55℃蒸发结晶;②趁热过滤;③_____________;④低于60℃干燥,得到产品。 (3)为了测定产品NaClO2的纯度,取上述所得产品12.5g溶于水配成1 L溶液,取出10.00mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(ClO2-被还原为C1-,杂质不参加反应),加入2~3滴淀粉溶液,用0.25mol·L-1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00mL,试计算产品NaClO2的纯度_______________________________。(提示:2Na2S2O3+I2==Na2S4O6+2NaI) (4)NaClO2溶液中存在ClO2、HClO2、ClO2-、C1-四种含氯微粒。经测定25℃备含氯微粒浓度随pH的变化情况如图所示(C1-没有画出)。
①酸性条件下NaClO2溶液中存在C1-的原因是________________________(用离子方程式解释)。 ②pH=5时,NaClO2溶液中ClO2、HClO2、ClO2-、C1-四种含氯微粒的浓度由大到小的顺序是____________________________________。
|
|
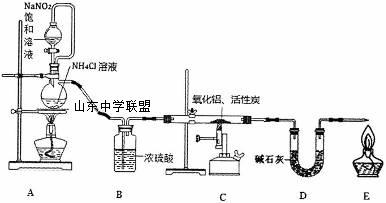
| 19. | 详细信息 |
|
氮化铝(室温下与水缓慢反应)是一种新型无机材料,广泛应用于集成电路生产领域。化学研究小组同学按下列流程制取氮化铝并测定所得产物中A1N的质量分数。 已知:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑。
回答下列问题: (1)检查装置气密性,加入药品,开始实验。最先点燃_______(“A”、“C”或“E”)处的酒精灯或酒精喷灯。 (2)装置A中发生反应的离子方程式为____________________,装置C中主要反应的化学方程式为____________________,制得的A1N中可能含有氧化铝、活性炭外还可能含有____________________。 (3)实验中发现氮气的产生速率过快,严重影响尾气的处理。实验中应采取的措施是______ ___________________________________________________(写出一种措施即可)。 (4)称取5.0g装置C中所得产物,加入NaOH溶液,测得生成氨气的体积为1.68L(标准状况),则所得产物中A1N的质量分数为____________________。 (5)也可用铝粉与氮气在1000℃时反应制取A1N。在铝粉中添加少量NH4Cl固体并充分混合,有利于A1N的制备,其主要原因是___________________________________________。
|
|
- 高中化学人教版 必修2 第一章 物质结构 元素周期律 第三节 化学键 离子键
- 高中化学人教版 选修五 第一章 第四节 有机物的分离和提纯
- 2016-2017年高三上册化学期中考试考试(广东省汕头市潮师高级中学)
- 2017-2018年高一12月月考化学考题带答案和解析(山西省太原市第五中学)
- 高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第三节 化学平衡 化学平衡第三课时
- 2016-2017年高二上册化学期中考试在线测验(广东省茂名市高州中学)
- 2017-2018年高一12月月考化学试卷(浙江省杭州市西湖高级中学)
- 2018届高三12月高考复习质量监测卷理综-化学考试(云南省曲靖市第一中学)