ж№–еҚ—д№қе№ҙзә§дёӢеӯҰжңҹдәәж•ҷзүҲеҲқдёӯеҢ–еӯҰз«һиөӣ
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„дёӯзҡ„дёӨз§Қзү©иҙЁеұһдәҺеҗҢдёҖз§Қзү©иҙЁзҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺзәҜзўұгҖҒзҒ«зўұВ В BпјҺз”ҹзҹізҒ°гҖҒзҶҹзҹізҒ° CпјҺж¶ҲзҹізҒ°гҖҒзҶҹзҹізҒ°В В DпјҺиӢҸжү“гҖҒе°ҸиӢҸжү“
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁиӮҜе®ҡдёәзәҜеҮҖзү©зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺз”ұеҗҢз§Қе…ғзҙ з»„жҲҗзҡ„зү©иҙЁ BпјҺз”ұдёҚеҗҢз§Қе…ғзҙ з»„жҲҗзҡ„зү©иҙЁ CпјҺз”ұеҗҢз§ҚеҲҶеӯҗжһ„жҲҗзҡ„зү©иҙЁ DпјҺз”ұдёҖз§Қе…ғзҙ зҡ„йҳізҰ»еӯҗи·ҹеҸҰдёҖз§Қе…ғзҙ зҡ„йҳҙзҰ»еӯҗжһ„жҲҗзҡ„зү©иҙЁ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯзҡ„дёҖз§ҚиғҪдёҺе…¶е®ғдёүз§Қзү©иҙЁйғҪеҸ‘з”ҹеҸҚеә”зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺй“ҒВ В BпјҺзЁҖзЎ«й…ёВ В CпјҺзўій…ёй’ В В DпјҺж°ўж°§еҢ–й’
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁж°ҙжә¶ж¶ІдёӯпјҢдёҖиҲ¬дёҚи·ҹе…¶д»–зү©иҙЁеҸ‘з”ҹеӨҚеҲҶи§ЈеҸҚеә”зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺAgNO3 BпјҺNaCl CпјҺNa2CO3В В В DпјҺNaNO3
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
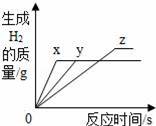
е°ҶзӯүиҙЁйҮҸзҡ„й•ҒгҖҒй“ҒгҖҒй”ҢпјҢеҲҶеҲ«ж”ҫе…Ҙдёүд»Ҫжә¶иҙЁиҙЁйҮҸеҲҶж•°зӣёеҗҢзҡ„зЁҖзӣҗй…ёдёӯпјҢеҸҚеә”з”ҹжҲҗзҡ„H2иҙЁйҮҸдёҺеҸҚеә”ж—¶й—ҙзҡ„е…ізі»еҰӮеӣҫжүҖзӨәпјҺж №жҚ®еӣҫдёӯзҡ„дҝЎжҒҜпјҢдҪңеҮәзҡ„еҲӨж–ӯдёҚжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү
AпјҺеӣҫзәҝxиЎЁзӨәй•Ғзҡ„еҸҚеә”жғ…еҶө BпјҺй“Ғж¶ҲиҖ—зҡ„зЁҖзӣҗй…ёиҙЁйҮҸжңҖеӨ§ CпјҺй•ҒгҖҒй”ҢдёҖе®ҡиҝҮйҮҸпјҢй“ҒеҸҜиғҪеҸҚеә”е®Ң DпјҺй•ҒдёҖе®ҡиҝҮйҮҸпјҢй”ҢгҖҒй“ҒеҸҜиғҪеҸҚеә”е®Ң
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ұNaгҖҒSгҖҒOгҖҒHдёӯзҡ„2з§ҚжҲ–3з§Қе…ғзҙ з»„жҲҗ4з§ҚеҢ–еҗҲзү©пјҺз”ІиғҪи·ҹBaCl2еҸҚеә”з”ҹжҲҗеҸҰеӨ–дёӨз§Қзӣҗпјӣд№ҷиғҪи·ҹNaOHеҸҚеә”з”ҹжҲҗзӣҗе’Ңж°ҙпјӣдёҷиғҪи·ҹHClеҸҚеә”з”ҹжҲҗзӣҗе’Ңж°ҙпјӣдёҒе‘ҲдёӯжҖ§пјҢи·ҹCaOжҲ–CO2еҢ–еҗҲз”ҹжҲҗзўұжҲ–й…ёпјҺеҲҷдёӢеҲ—еҲӨж–ӯй”ҷиҜҜзҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺз”ІеҸҜиғҪжҳҜNa2SO4В В BпјҺд№ҷдёҖе®ҡжҳҜH2SO4 CпјҺдёҷеҸҜиғҪжҳҜNaOH DпјҺдёҒдёҖе®ҡжҳҜH2O
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
е°ҶдёҖе®ҡиҙЁйҮҸ37%зҡ„жө“зӣҗй…ёеҠ зғӯи’ёеҸ‘жҺү20gж°ҙпјҢжүҖеҫ—зӣҗй…ёзҡ„иҙЁйҮҸеҲҶж•°пјҲгҖҖгҖҖпјү AпјҺеўһеӨ§ BпјҺдёҚеҸҳ CпјҺеҮҸе°Ҹ DпјҺж— жі•зЎ®е®ҡ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘзўій…ёж°ўй’ҷгҖ”CaпјҲHCO3пјү2гҖ•еӣәдҪ“еҠ зғӯжҳ“еҲҶи§Јз”ҹдә§зўій…ёй’ҷгҖҒж°ҙе’ҢдәҢж°§еҢ–зўіпјҺзҺ°е°ҶдёҖе®ҡиҙЁйҮҸзҡ„зўій…ёж°ўй’ҷеҠ зғӯдёҖж®өж—¶й—ҙпјҢеҶ·еҚҙпјҢз§°йҮҸпјҢеү©дҪҷеӣәдҪ“зҡ„иҙЁйҮҸжҳҜеҺҹеӣәдҪ“иҙЁйҮҸзҡ„дёҖеҚҠпјҢеҲҷиҜҘзўій…ёж°ўй’ҷеҲҶи§Јзҡ„зҷҫеҲҶзҺҮжҳҜпјҲгҖҖгҖҖпјү AпјҺ100% BпјҺ80%В CпјҺ50%В DпјҺ30%
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
д»ҠжңүдёҖж··еҗҲзү©зҡ„ж°ҙжә¶ж¶ІпјҢеҸӘеҸҜиғҪеҗ«жңүд»ҘдёӢзҰ»еӯҗдёӯзҡ„иӢҘе№Із§ҚпјҡNa+гҖҒNH4+гҖҒBa2+гҖҒClп№ЈгҖҒCO32п№ЈгҖҒSO42п№ЈпјҺзҺ°еҸ–дёӨд»Ҫ200mLжә¶ж¶ІиҝӣиЎҢеҰӮдёӢе®һйӘҢпјҡ①第дёҖд»ҪеҠ и¶ійҮҸNaOHжә¶ж¶ІпјҢеҠ зғӯпјҢ收йӣҶеҲ°ж°”дҪ“0.68gпјӣ②第дәҢд»ҪеҠ и¶ійҮҸBaCl2жә¶ж¶ІеҗҺпјҢеҫ—е№ІзҮҘжІүж·Җ6.27gпјҢз»Ҹи¶ійҮҸзӣҗй…ёжҙ—ж¶ӨгҖҒе№ІзҮҘеҗҺпјҢжІүж·ҖиҙЁйҮҸдёә2.33gпјҺж №жҚ®дёҠиҝ°е®һйӘҢпјҢд»ҘдёӢжҺЁжөӢжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺдёҖе®ҡдёҚеӯҳеңЁBa2+пјҢеҸҜиғҪеӯҳеңЁNH4+ BпјҺдёҖе®ҡеӯҳеңЁCO32п№Ј CпјҺдёҖе®ҡеӯҳеңЁNa+ DпјҺдёҖе®ҡдёҚеӯҳеңЁClп№Ј
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жә¶ж¶ІдёӯпјҢжүҖеҗ«зІ’еӯҗж•°зӣ®жңҖеӨҡзҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺ10g 4%зҡ„ж°ҜеҢ–й’ жә¶ж¶ІВ В BпјҺ20g 3%зҡ„ж°ҜеҢ–й’ жә¶ж¶І CпјҺ30g 2%зҡ„ж°ҜеҢ–й’ жә¶ж¶ІВ В DпјҺ40g 1%зҡ„ж°ҜеҢ–й’ жә¶ж¶І
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүдёҖе®ҡиҙЁйҮҸзҡ„й•Ғй“ңеҗҲйҮ‘пјҢеҠ е…ҘйҖӮйҮҸзЁҖзӣҗй…ёжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢиҝҮж»ӨпјҢеҗ‘ж»Өж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°ўж°§еҢ–й’ жә¶ж¶ІпјҢз”ҹжҲҗжІүж·Җзҡ„иҙЁйҮҸжҒ°еҘҪзӯүдәҺеҺҹеҗҲйҮ‘зҡ„иҙЁйҮҸпјҢеҲҷеҺҹеҗҲйҮ‘дёӯй•Ғзҡ„иҙЁйҮҸеҲҶж•°дёәпјҲгҖҖгҖҖпјү AпјҺ11.4%В В В BпјҺ21.4%В В В CпјҺ31.4%В В В DпјҺ41.4%
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ұNaHSгҖҒMgSO4гҖҒNaHSO3з»„жҲҗзҡ„ж··еҗҲзү©дёӯпјҢе·ІзҹҘSе…ғзҙ зҡ„иҙЁйҮҸеҲҶж•°wпјҲSпјү=a%пјҢеҲҷOе…ғзҙ зҡ„иҙЁйҮҸеҲҶж•°wпјҲOпјүдёәпјҲгҖҖгҖҖпјү AпјҺ1.75a%В В BпјҺ1п№Ј1.75a%В В В CпјҺ1.25a%В В DпјҺж— жі•и®Ўз®—
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢиғҪи§ӮеҜҹеҲ°жҳҺжҳҫзҺ°иұЎзҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺж°ўж°§еҢ–й’ жә¶ж¶Іж»ҙе…Ҙж°ҜеҢ–й’Ўжә¶ж¶Ідёӯ BпјҺеҗ‘ж°ҜеҢ–й’ҷжә¶ж¶ІдёӯйҖҡе…ҘдәҢж°§еҢ–зўі CпјҺзЎқ酸银жә¶ж¶Іж»ҙе…Ҙж°ҜеҢ–й’ жә¶ж¶Ідёӯ DпјҺзЎқй…ёй’ҫжә¶ж¶Іж»ҙе…Ҙж°ҜеҢ–й’ жә¶ж¶Ідёӯ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүдёҖй•Ғе’Ңй“Ғз»„жҲҗзҡ„еҗҲйҮ‘пјҢдёҺи¶ійҮҸзЁҖзӣҗй…ёеҸҚеә”з”ҹжҲҗж°ўж°”0.1gпјҢеҲҷеҺҹеҗҲйҮ‘зҡ„иҙЁйҮҸеҸҜиғҪдёәпјҲгҖҖгҖҖпјү AпјҺ1.2g BпјҺ2.8g CпјҺ2gВ В DпјҺ3g
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘дёҖжқҜж°ҜеҢ–й’Ўжә¶ж¶ІдёӯйҖҗж»ҙеҠ е…ҘзЁҖзЎ«й…ёпјҢиҮіжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢиҝҮж»ӨпјҢжүҖеҫ—жІүж·Җзҡ„иҙЁйҮҸеҲҡеҘҪдёҺжүҖеҠ зЁҖзЎ«й…ёзҡ„иҙЁйҮҸзӣёзӯүпјҢеҲҷжүҖеҠ зЁҖзЎ«й…ёжә¶иҙЁзҡ„иҙЁйҮҸеҲҶж•°дёәпјҲгҖҖгҖҖпјү AпјҺ22.1%В В В BпјҺ32.1%В В В CпјҺ42.1%В В В DпјҺ52.1%
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
зҺ°жңү16g Fe2O3е’ҢCuOзҡ„ж··еҗҲзІүжң«пјҢжҠҠиҜҘж··еҗҲзү©е…ЁйғЁеҠ е…ҘеҲ°100gи¶ійҮҸзҡ„зЁҖзЎ«й…ёдёӯпјҢеӣәдҪ“зІүжң«е®Ңе…Ёжә¶и§ЈпјҺ然еҗҺж»ҙеҠ 150g16%зҡ„ж°ўж°§еҢ–й’ жә¶ж¶ІпјҢжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢиҝҮж»ӨпјҺиҜ•и®Ўз®—пјҡ пјҲ1пјүжүҖеҫ—ж»Өж¶Ідёӯзҡ„жә¶иҙЁжҳҜгҖҖпјҲеҶҷеҢ–еӯҰејҸпјүпјҢиҙЁйҮҸдёәгҖҖгҖҖgпјҺ пјҲ2пјүжүҖз”ЁзЁҖзЎ«й…ёжә¶иҙЁзҡ„иҙЁйҮҸеҲҶж•°пјҺ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
д»ҺHгҖҒOгҖҒNгҖҒSгҖҒFeгҖҒCuгҖҒBaзӯү7з§Қе…ғзҙ дёӯйҖүжӢ©жҒ°еҪ“зҡ„е…ғзҙ пјҢз”ЁзҰ»еӯҗз¬ҰеҸ·гҖҒеҢ–еӯҰејҸжҲ–еҢ–еӯҰж–№зЁӢејҸеЎ«з©әпјҡ пјҲ1пјүзЎ«й…ёй“ңдёӯзҡ„йҳҙзҰ»еӯҗгҖҖгҖҖпјӣзЎ«й…ёдәҡй“Ғдёӯзҡ„йҳізҰ»еӯҗгҖҖпјӣи“қиүІжІүж·ҖгҖҖгҖҖпјҺ пјҲ2пјүиғҪдҪҝжңЁжқҗгҖҒзәёеј еҸҳй»‘зҡ„й…ёгҖҖгҖҖпјӣжә¶дәҺж°ҙеҗҺжә¶ж¶ІжҳҫзўұжҖ§зҡ„ж°”дҪ“гҖҖгҖҖпјҺ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘCaCl2жә¶ж¶Іе’ҢNaHCO3жә¶ж¶ІеҸҚеә”з”ҹжҲҗCaCO3жІүж·ҖпјҺдёәиЎЁзӨәиҝҷдёӘеҸҚеә”еҶҷеҮәдәҶдёӢеҲ—дёӨдёӘеҢ–еӯҰж–№зЁӢејҸпјҡ第дёҖдёӘпјҡCaCl2+NaHCO3в•җCaCO3вҶ“+NaCl+HClпјҢ第дәҢдёӘпјҡCaCl2+2NaHCO3в•җCaCO3вҶ“+2NaCl+CO2вҶ‘+H2O дҪ и®Өдёәе“ӘдёҖдёӘеҢ–еӯҰж–№зЁӢејҸдёҚеҗҲзҗҶпјҢ并з®Җиҝ°зҗҶз”ұпјҺгҖҖгҖҖпјӣ пјҲ2пјүе·ІзҹҘйҡҫжә¶зҡ„зү©иҙЁеңЁдёҖе®ҡжқЎд»¶дёӢеҸҜиҪ¬еҢ–жҲҗжӣҙйҡҫжә¶зҡ„зү©иҙЁпјҺе°ҶзҷҪиүІMgпјҲOHпјү2еҠ еҲ°FeCl3жә¶ж¶ІдёӯжңүзәўиӨҗиүІжІүж·Җз”ҹжҲҗпјҺиҜ·еҶҷеҮәеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸгҖҖгҖҖпјҺ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘеҗ‘зўій…ёй’ жә¶ж¶ІдёӯйҖҗж»ҙеҠ зЁҖзӣҗй…ёпјҢеҸҚеә”еҲҶдёӨжӯҘиҝӣиЎҢпјҡ 第дёҖжӯҘпјҡNa2CO3+HCl=NaHCO3+NaClпјҢ第дәҢжӯҘNaHCO3и·ҹзӣҗй…ёеҸҚеә”ж”ҫеҮәдәҢж°§еҢ–зўіпјҺ е®һйӘҢе®Өжңүз”ІгҖҒд№ҷдёӨз“¶ж— иүІжә¶ж¶ІпјҢе…¶дёӯдёҖ瓶жҳҜзЁҖзӣҗй…ёпјҢеҸҰдёҖ瓶жҳҜзўій…ёй’ жә¶ж¶ІпјҺдёәйүҙеҲ«з”ІгҖҒд№ҷдёӨ瓶жә¶ж¶ІпјҢиҝӣиЎҢд»ҘдёӢе®һйӘҢпјҡ в‘ йҮҸеҸ–25.00mLз”Іжә¶ж¶ІпјҢеҗ‘е…¶дёӯзј“ж…ўж»ҙе…Ҙд№ҷжә¶ж¶І15.00mLпјҢе…ұ收йӣҶеҲ°224mLж°”дҪ“пјӣ в‘ЎйҮҸеҸ–15.00mLд№ҷжә¶ж¶ІпјҢеҗ‘е…¶дёӯзј“ж…ўж»ҙе…Ҙз”Іжә¶ж¶І25.00mLпјҢе…ұ收йӣҶеҲ°112mLж°”дҪ“пјҺ жҚ®жӯӨеҲӨж–ӯпјҡз”ІжҳҜгҖҖгҖҖжә¶ж¶ІпјҢд№ҷжҳҜгҖҖжә¶ж¶ІпјҲеқҮеЎ«еҢ–еӯҰејҸпјүпјҺ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗдёҚзәҜзҡ„зғ§зўұж ·е“Ғдёӯеҗ«жңүNa2CO3 3.8%гҖҒNa2O 5.8%гҖҒNaOH 90.4%пјҺеҸ–Mе…Ӣж ·е“ҒпјҢжә¶дәҺиҙЁйҮҸеҲҶж•°дёә18.25%зҡ„зӣҗй…ёжә¶ж¶І100gдёӯпјҢ并用30%зҡ„NaOHжә¶ж¶ІжқҘдёӯе’Ңеү©дҪҷзҡ„зӣҗй…ёиҮідёӯжҖ§пјҺжҠҠеҸҚеә”еҗҺзҡ„жә¶ж¶Іи’ёе№ІеҗҺеҸҜеҫ—еҲ°еӣәдҪ“зҡ„иҙЁйҮҸжҳҜгҖҖgпјҺ
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ІгҖҒд№ҷдёӨеҗҢеӯҰеңЁе®Өжё©дёӢеҗ„еҸ–50gжҹҗжә¶ж¶ІеҲҶеҲ«еҒҡе®һйӘҢпјҢз”Іе°Ҷжә¶ж¶Іи’ёеҸ‘жҺү10gж°ҙеҗҺпјҢеҶ·еҚҙеҲ°е®Өжё©еҫ—еҲ°жҷ¶дҪ“1.2gпјҲжҷ¶дҪ“дёҚеҗ«з»“жҷ¶ж°ҙпјүпјҢд№ҷе°Ҷжә¶ж¶Іи’ёеҸ‘жҺү15gж°ҙеҗҺеҶ·еҚҙеҲ°е®Өжё©еҫ—еҲ°жҷ¶дҪ“2.4gпјҢеҲҷеҺҹ50gжә¶ж¶Ідёӯжә¶иҙЁзҡ„иҙЁйҮҸеҲҶж•°дёәгҖҖпјҺ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
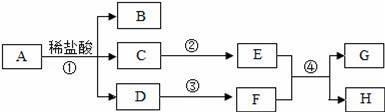
AпҪһHжҳҜеҲқдёӯеҢ–еӯҰеёёи§Ғзҡ„зү©иҙЁпјҢе…¶дёӯAжҳҜеҸ‘й…өзІүзҡ„дё»иҰҒжҲҗеҲҶд№ӢдёҖпјҢBжҳҜеёёз”Ёи°ғе‘іе“ҒпјҢEгҖҒFзҡ„дҝ—з§°еҲҶеҲ«жҳҜзҶҹзҹізҒ°гҖҒзәҜзўұпјҺе®ғ们д№Ӣй—ҙзҡ„зӣёдә’иҪ¬еҢ–е…ізі»еҰӮеӣҫпјҺ
пјҲ1пјүеҶҷеҮәAгҖҒBзҡ„еҢ–еӯҰејҸпјҡAгҖҖгҖҖпјҢBгҖҖгҖҖпјҺ пјҲ2пјүеңЁзү©иҙЁзҡ„еҲҶзұ»дёӯпјҢDеұһдәҺгҖҖгҖҖпјҲеЎ«вҖңй…ёвҖқгҖҒвҖңзўұвҖқгҖҒвҖңзӣҗвҖқжҲ–вҖңж°§еҢ–зү©вҖқпјүпјҺ пјҲ3пјүеӣҫдёӯеҸҚеә”в‘Ўзҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖҖпјҺ пјҲ4пјүеӣҫдёӯеҸҚеә”в‘Јзҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖҖпјҺ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
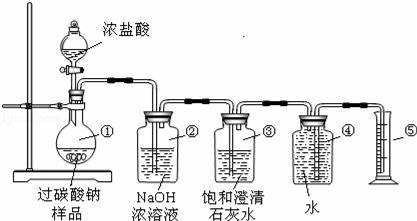
иҝҮзўій…ёй’ пјҲNa2CO4пјүеңЁжҙ—ж¶ӨгҖҒеҚ°жҹ“гҖҒзәәз»ҮгҖҒйҖ зәёгҖҒеҢ»иҚҜеҚ«з”ҹзӯүйўҶеҹҹжңүеӨ§йҮҸеә”з”ЁпјҢжҹҗеҢ–еӯҰз ”з©¶жҖ§еӯҰд№ е°Ҹз»„и®ҫ计并е®ҢжҲҗдәҶеҰӮдёӢе®һйӘҢпјҺ гҖҗе®һйӘҢзӣ®зҡ„гҖ‘жөӢе®ҡиҝҮзўій…ёй’ ж ·е“ҒпјҲеҗ«жңүзҡ„жқӮиҙЁдёҚжә¶дәҺж°ҙдё”дёҚдёҺй…ёеҸҚеә”пјүзҡ„зәҜеәҰпјҺ гҖҗе®һйӘҢеҺҹзҗҶгҖ‘2Na2CO4+4HClв•җ4NaCl+2CO2вҶ‘+O2вҶ‘+2H2O гҖҗе®һйӘҢиЈ…зҪ®гҖ‘
гҖҗдәӨжөҒдёҺи®Ёи®әгҖ‘ в… пјҺпјҲ1пјүиЈ…зҪ®в‘Је’Ңв‘ӨеңЁе®һйӘҢдёӯе…ұеҗҢзҡ„дҪңз”ЁжҳҜгҖҖгҖҖпјҺ пјҲ2пјүиЈ…зҪ®в‘ЎдёӯеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜгҖҖгҖҖпјӣ пјҲ3пјүиЈ…зҪ®в‘ўзҡ„дҪңз”ЁжҳҜгҖҖгҖҖпјӣ пјҲ4пјүз§°еҸ–йҖӮйҮҸж ·е“ҒдёҺи¶ійҮҸжө“зӣҗй…ёе……еҲҶеҸҚеә”еҗҺпјҢ收йӣҶеҲ°зҡ„ж°§ж°”зҡ„дҪ“з§Ҝдёә0.25LпјҲе·ІзҹҘиҜҘе®һйӘҢжқЎд»¶дёӢж°§ж°”зҡ„еҜҶеәҰдёә1.28g/LпјүпјҢеҲҷз§°еҸ–зҡ„ж ·е“ҒиҙЁйҮҸеә”еӨ§дәҺгҖҖгҖҖgпјӣ в…ЎпјҺд№ҷеҗҢеӯҰи®ӨдёәжөӢе®ҡдә§зү©дёӯCO2зҡ„иҙЁйҮҸпјҲеҚіеҸҚеә”еүҚеҗҺиЈ…зҪ®в‘Ўзҡ„иҙЁйҮҸе·®пјүе°ұеҸҜжөӢе®ҡж ·е“Ғзҡ„зәҜеәҰпјҺдҪҶеҲ©з”ЁдёҠиҝ°е®һйӘҢиЈ…зҪ®жөӢеҫ—CO2зҡ„иҙЁйҮҸе№¶и®Ўз®—ж ·е“Ғзҡ„зәҜеәҰпјҢз»“жһңдјҡеҒҸй«ҳпјҢдҪ и®ӨдёәеҺҹеӣ еҸҜиғҪжҳҜгҖҖгҖҖпјҲеЎ«еәҸеҸ·пјү AпјҺжө“зӣҗй…ёжҳ“жҢҘеҸ‘пјҢдә§з”ҹзҡ„ж°ҜеҢ–ж°ўж°”дҪ“иў«иЈ…зҪ®в‘Ўеҗёж”¶ BпјҺдәҢж°§еҢ–зўіж°”дҪ“йҖёеҮәж—¶еёҰеҮәзҡ„ж°ҙи’ёж°”еңЁиЈ…зҪ®в‘ЎдёӯеҶ·еҮқиҖҢиў«еҗёж”¶ CпјҺиЈ…зҪ®в‘ гҖҒв‘ЎеҶ…з©әж°”дёӯзҡ„дәҢж°§еҢ–зўіиў«иЈ…зҪ®в‘Ўеҗёж”¶ в…ўпјҺдёҷеҗҢеӯҰжҸҗеҮәдәҶдёҖз§Қж–°ж–№жЎҲпјҢеҫ—еҲ°дәҶеӨ§е®¶зҡ„дёҖиҮҙи®ӨеҸҜпјҡз§°еҸ–ж ·е“Ғ12.5gпјҢж»ҙеҠ и¶ійҮҸжө“зӣҗй…ёиҮіж ·е“ҒеҸҚеә”е®Ңе…ЁпјҢеҶҚе°Ҷзғ§з“¶дёӯжүҖжңүзҡ„ж¶ІдҪ“и’ёеҸ‘гҖҒз»“жҷ¶гҖҒзғҳе№ІпјҢз§°еҫ—ж°ҜеҢ–й’ еӣәдҪ“11.7gпјҺеҲҷиҜҘж ·е“Ғзҡ„зәҜеәҰдёәгҖҖ гҖҖпјҺ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүдёҖз§Қз”ұж°ҜеҢ–й’ е’ҢзЎқй…ёй’ з»„жҲҗзҡ„еӣәдҪ“ж··еҗҲзү©12.35gпјҢеҠ е…Ҙ27gж°ҙдҪҝе…¶е®Ңе…Ёжә¶и§ЈпјҢж»ҙе…ҘзЎқ酸银жә¶ж¶І75gпјҢжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢз”ҹжҲҗзҷҪиүІжІүж·Җ14.35gпјҢиҝҮж»ӨпјҺи®Ўз®—иҝҮж»ӨеҗҺжүҖеҫ—жә¶ж¶Ідёӯжә¶иҙЁзҡ„иҙЁйҮҸеҲҶж•°пјҺ
|
|
- жұҹжІ№еёӮ2018е№ҙд№қе№ҙзә§дёҠеӯҰжңҹеҢ–еӯҰжңҲиҖғжөӢйӘҢеёҰеҸӮиҖғзӯ”жЎҲдёҺи§Јжһҗ
- 2017-2018е№ҙ科зІӨзүҲд№қе№ҙзә§еҢ–еӯҰ第дәҢеҚ•е…ғ第дёҖиҠӮеҹәзЎҖз»ғд№
- 2019еұҠд№қе№ҙзә§дёӢеӯҰжңҹ第дёүж¬ЎжЁЎжӢҹеҢ–еӯҰиҖғиҜ•пјҲе®ҒеӨҸ银е·қеёӮе”җеҫ•еӣһж°‘дёӯеӯҰпјү
- 2018-2019е№ҙеҲқдёүдёҠеҚҠжңҹжңҹжң«еҢ–еӯҰпјҲж№–еҚ—зңҒжұқеҹҺеҺҝзғӯж°ҙдёӯеӯҰпјү
- 2019-2020е№ҙеҲқдёүдёҠжңҹжңҹжң«еҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲеҗүжһ—зңҒй•ҝжҳҘеёӮжңқйҳіеҢәпјү
- 2018-2019е№ҙеҲқдёүеүҚеҚҠжңҹжңҹжң«еҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲж№–еҚ—зңҒй•ҝжІҷеёӮжңӣеҹҺеҢәпјү
- иӢҸе·һеёӮ2018е№ҙд№қе№ҙзә§еҢ–еӯҰдёҠеҚҠжңҹжңҹдёӯиҖғиҜ•иҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- 2019-2020е№ҙеҲқдёүдёӢеҶҢжңҹдёӯеҢ–еӯҰпјҲз”ҳиӮғзңҒе®ҡиҘҝеёӮжёӯжәҗеҺҝ田家河дёӯеӯҰпјү