吉林省吉林市2018-2019学年高考理综-化学三模考试试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与资源利用、环境保护及社会可持续发展密切相关。下列说法错误的是( )
A . 煤转化为水煤气加以利用是为了节约燃料成本
B . 利用太阳能蒸发淡化海水的过程属于物理变化
C . 在阳光照射下,利用水和二氧化碳合成的甲醇属于可再生燃料
D . 用二氧化碳合成可降解塑料聚碳酸酯,实现“碳”的循环利用
|
|
| 2. 单选题 | |
|
一种形状像蝴蝶结的有机分子Bowtiediene,其形状和结构如图所示,下列有关该分子的说法中错误的是( )
A . 该分子中所有碳原子在同一平面内
B . 生成1molC5H12至少需要4molH2
C . 三氯代物只有一种
D . 与其互为同分异构体,且只含碳碳三键的链烃有两种
|
|
| 3. 单选题 | |
|
用NA表示阿伏加德罗常数的数值,下列说法中不正确的是( )
A . 20gD2O含有的电子数为10NA
B . 标准状况下,22.4LCl2通入足量NaOH溶液中,完全反应时转移的电子数为2NA
C . 1L0.1mol·L-1NH4NO3溶液中的氮原子数为0.2NA
D . 25℃时,1.0LpH=12的NaClO溶液中由水电离出的OH-的数目为0.01NA
|
|
| 4. 单选题 | |
|
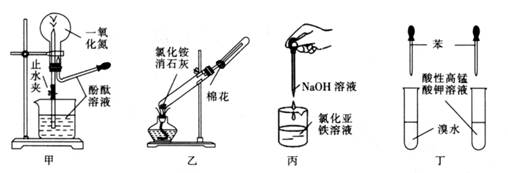
下列药品和装置合理且能完成相应实验的是( )
A . 甲图为喷泉实验
B . 乙图为实验室制取并收集氨气
C . 丙图为制备氢氧化亚铁的实验
D . 丁图为验证苯中是否有碳碳双键的实验
|
|
| 5. 单选题 | |
|
短周期部分元素原子半径与原子序数的关系如图,下列说法正确的是( )
A . 相同条件下,Y的氢化物比X的氢化物更稳定,熔沸点也更高
B . A单质通常保存在煤油中
C . Y的单质能从含R简单离子的水溶液中置换出R单质
D . M的最高价氧化物对应水化物能分别与Z、R的最高价氧化物对应水化物反应
|
|
| 6. 单选题 | |
|
一种新型电化学装置如图所示:
装置工作时,下列说法正确的是( )
A . 电能转化为化学能
B . Na+向正极区迁移
C . Pt/C极的电极反应式为2CO2+2H2O-2e-=2HCO3- +H2
D . 金属钠极上的电势比Pt/C极上的高
|
|
| 7. 单选题 | |
|
已知:AG=
 室温下用0.01mol·L-1的NH3·H2O滴定20.00mL0.01mol·L-1某一元酸HQ的结果如图所示,下列说法中正确的是( ) 室温下用0.01mol·L-1的NH3·H2O滴定20.00mL0.01mol·L-1某一元酸HQ的结果如图所示,下列说法中正确的是( )
A . HQ属于弱酸
B . 整个过程中,C点时水的电离程度最大
C . Kb(NH3·H2O)的数量级为10-5
D . E点对应溶液中:c(OH-)+c(NH3·H2O)=c(N
 )+c(H+) )+c(H+)
|
|
| 8. 综合题 | |
|
二茂铁在常温下为橙黄色粉末,有樟脑气味,用作节能、消烟、助燃添加剂等。可用下列方法合成:
回答下列问题:
|
|
| 9. 综合题 | |
|
砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
|
|
| 10. 综合题 | |
|
某校同学设计实验用乙烯与Br2的CCl4溶液反应制备1,2-二溴乙烷。回答下列问题:
|
|
- 安徽省黄山市2020-2021学年高一上学期期末考试化学试题
- 安徽省江淮名校宣城2020-2021学年高一上学期期末考试化学试题
- 广西百色市2020-2021学年高二上学期期末教学质量调研测试化学试题
- 广西贵港市2020-2021学年高二上学期期末教学质量监测化学试题
- 广西桂林市2020-2021学年高二上学期期末质量检测化学试题
- 广西河池市2020-2021学年高二上学期期末教学质量检测化学试题
- 广西来宾市2020-2021学年高二上学期期末教学质量检测化学试题
- 广西南宁市2020-2021学年高二上学期期末考试化学试题
- 广西钦州市2020-2021学年高二上学期期末教学质量监测化学试题
- 陕西省宝鸡市渭滨区2020-2021学年高二上学期期末考试化学试题
- 陕西省汉中市2020-2021学年高二上学期期末考试化学试题
- 广西北海市2020-2021学年高一上学期期末教学质量检测化学试题








 2HAsO42-的lgK= 。
2HAsO42-的lgK= 。 As4(g)+3CO(g) △H2=bkJ·mol-1
As4(g)+3CO(g) △H2=bkJ·mol-1


 C2H4↑+H2O主要副反应为C2H5OH+6H2SO4(浓)
C2H4↑+H2O主要副反应为C2H5OH+6H2SO4(浓)  6SO2↑+2CO2↑+9H2O
6SO2↑+2CO2↑+9H2O



