2016-2017学年云南省昭通市高三上学期期末化学试卷
教材版本:化学
试卷分类:化学高三上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
下面是用硫酸钙生产硫酸、漂白粉等一系列物质的流程图.下列说法正确的是( )
A . CO、SO2、SO3均是酸性氧化物
B . 图示转化反应均为氧化还原反应
C . 工业上利用Cl2和澄清石灰水反应来制取漂白粉
D . 用CO合成CH3OH,原子利用率为100%
|
|
| 2. 单选题 | |
|
已知NA为阿伏加德罗常数的数值,下列说法正确的是( )
A . 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH﹣数目为0.2NA
B . ﹣定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA
C . 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
D . 4.6g乙醇含有共价键的数目为0.9NA
|
|
| 3. 单选题 | |
|
一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O.下列有关说法不正确的是( )
A . 检测时,电解质溶液中的H+向正极移动
B . 若有 0.4 mol电子转移,则消耗 2.24 L氧气
C . 正极上发生还原反应,负极上发生氧化反应
D . 负极上的反应为:CH3CH2OH﹣4e﹣+H2O═CH3COOH+4H+
|
|
| 4. 单选题 | |
|
下列关于有机物的说法正确的是( )
A . 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应
B . 1mol葡萄糖能水解生成2mol乙醇和2mol二氧化碳
C . 戊烷的一氯代物和丙烷的二氯代物的同分异构体数目相同
D . 异丙醇能发生取代反应、氧化反应、消去反应等
|
|
| 5. 单选题 | |
|
X、Y、Z、R是四种短周期主族元素,X原子最外层电子数是次外层的2倍,Y元素在地壳中含量最多,Z元素金属性最强,R原子的核外电子数是X、Z核外电子数之和,下列叙述一定正确的是( )
A . 含氧酸酸性R>X
B . 简单氢化物稳定性Y<X
C . 最高正化合价Z<X<Y<R
D . 由Z和R形成的化合物为离子化合物
|
|
| 6. 单选题 | |||||||||||||||||||||
|
下列实验的现象和所得结论均正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 7. 单选题 | |
|
下列说法正确的是( )
A . 常温下.NH4Cl溶液加水稀释,
 增大
B . 0.1mol/LNa2CO3溶液加热后,溶液的pH减小
C . 室温下稀释O.1mol/LCH3COOH溶液,溶液的导电能力减弱,因此溶液中所有离子浓度均减小
D . 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进Fe3+水解 增大
B . 0.1mol/LNa2CO3溶液加热后,溶液的pH减小
C . 室温下稀释O.1mol/LCH3COOH溶液,溶液的导电能力减弱,因此溶液中所有离子浓度均减小
D . 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进Fe3+水解
|
|
| 8. 实验探究题 | |
|
氮化铝(AlN)是一种新型无机非金属材料.为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中AlN的含量,某实验小组设计了如下两种实验方案. 已知:AlN+NaOH+H2O=NaAlO2+NH3↑ 【方案l】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去).
|
|
| 9. 综合题 | |
|
硫单质及其化合物在工农业生产中有着重要的应用,请回答下列问题:
|
|
| 10. 综合题 | |
|
钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4 , TiOSO4遇水会水解. 请回答下列问题:
|
|
- 高中化学人教版(新课标)必修1 第三章第三节 用途广泛的金属材料
- 2015-2016学年黑龙江省鹤岗市绥滨一中高一下学期期末化学试卷
- 2019年高考理综化学真题试卷(全国Ⅲ卷)
- 北京101中学2017-2018学年高一上学期化学期末考试试卷
- 安徽省滁州市明光中学2019-2020学年高一下学期化学开学考试卷
- 2015-2016学年甘肃省天水三中高一下学期第一次段考化学试卷
- 2015-2016学年四川省广安市恒升中学高一上学期第二次月考化学试卷
- 上海市静安区2020年高考化学二模试卷
- 安徽省黄山市2018-2019学年高二上学期化学期末考试试卷
- 河南省焦作市2016-2017学年高二上学期化学期中考试试卷
- 北京市房山区2019-2020学年高二下学期化学期末考试试卷
- 备考2018年高考化学一轮基础复习:专题28 食品中的有机化合物及烃的衍生物




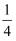 CaSO4(s)+CO(g)⇌
CaSO4(s)+CO(g)⇌ 



