广西北流市实验中学2019-2020学年高二下学期化学期中考试试卷
广西北流市实验中学2019-2020学年高二下学期化学期中考试试卷
教材版本:化学
试卷分类:化学高二下学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高二下学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
下列说法正确的是( )
A . 植物油氢化过程中发生了加成反应
B . 淀粉和纤维素互为同分异构体
C . 环己烷与苯可用酸性KMnO4溶液鉴别
D . 水可以用来分离溴苯和苯的混合物
|
|
| 2. 单选题 | |
|
锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O=2Zn(OH)42-。下列说法正确的是( )
A . 充电时,电解质溶液中K+向阳极移动
B . 充电时,电解质溶液中c(OH-) 逐渐减小
C . 放电时,负极反应为:Zn+4OH–-2e–= Zn(OH)42-
D . 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
|
|
| 3. 单选题 | |
|
W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是()
A . 原子半径大小为W<X<Y<Z
B . X的氢化物水溶液酸性强于Z的
C . Y2W2与ZW2均含有非极性共价键
D . 标准状况下W的单质状态与X的相同
|
|
| 4. 单选题 | |
|
下列有关电解质溶液的说法正确的是( )
A . 向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中
 减小
B . 将CH3COONa溶液从20℃升温至30℃,溶液中 减小
B . 将CH3COONa溶液从20℃升温至30℃,溶液中  增大
C . 向盐酸中加入氨水至中性,溶液中 增大
C . 向盐酸中加入氨水至中性,溶液中  >1
D . 向AgCl、AgBr的饱和溶液中加入少量AgNO3 , 溶液中 >1
D . 向AgCl、AgBr的饱和溶液中加入少量AgNO3 , 溶液中  不变 不变
|
|
| 5. 单选题 | ||||||||||||||||
|
下列实验操作规范且能达到目的的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 6. 单选题 | |
|
化学与生活密切相关。下列说法错误的是( )
A . 泡沫灭火器可用于一般的灭火,也适用于电器灭火
B . 疫苗一般应冷藏存放,以避免蛋白质变性
C . 家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D . 电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
|
|
| 7. 单选题 | |
 为阿伏加德罗常数的值。下列说法正确的是( ) 为阿伏加德罗常数的值。下列说法正确的是( )
A . 0.1 mol 的
 中,含有 中,含有  个 个 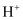 C . 2.24L(标准状况)苯在O2中完全燃烧,得到
C . 2.24L(标准状况)苯在O2中完全燃烧,得到  个P-Cl键 个P-Cl键
|
|
| 8. 实验探究题 | |
|
ClNO(名称:亚硝酰氯,熔点﹣64.5℃,沸点:﹣5.5℃)是有机物合成中的重要试剂,为红褐色液体或黄色气体,与水发生反应:2ClNO+H2O=NO+NO2+2HCl,某学习小组在实验室用Cl2和NO按如图装置制备ClNO,并测定其纯度。请回答问题:
|
|
| 9. 综合题 | |||||||||||||
|
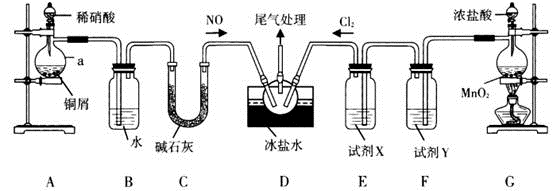
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O。工艺流程如下:
(一定条件下, 已知: 生成氢氧化物沉淀的pH
|
|||||||||||||
| 10. 综合题 | |
|
砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
|
|
高中化学 试卷推荐
- 人教版化学高二选修4第二章第四节化学反应进行的方向同步练习
- 浙江省嘉兴市2016-2017学年高一上学期期末考试试卷
- 专题07:镁、铝及其化合物
- 2016年高考理综真题试卷(化学部分)(天津卷)
- 2017_2018学年高中化学人教版选修四 第四章电化学基础4.2化学电源b
- 2017年江西省高考化学模拟试卷
- 2016年山东省菏泽市成武一中高考化学三模试卷
- 备考2018年高考化学一轮基础复习:专题14 原子结构 核外电子排布
- 湖南省永州市2019-2020学年高一下学期化学期末考试试卷
- 陕西省延安市实验中学大学区校际联盟2016-2017学年高二上学期化学期末考试试卷(A卷)
- 湖南师大附中2017-2018学年高考理综-化学一模考试试卷
- 江苏省南京市2019-2020学年高二下学期化学期末考试试卷
最近更新
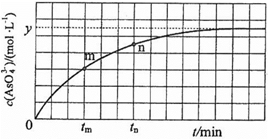
 可与Mn2+反应生成MnO2)
可与Mn2+反应生成MnO2)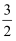 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1  O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2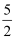 O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3 (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq) 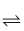
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c(