й«ҳдёӯеҢ–еӯҰдәәж•ҷзүҲпјҲ2019пјүйҖүжӢ©жҖ§еҝ…дҝ®1第дёүз« е®һйӘҢжҙ»еҠЁ3зӣҗзұ»ж°ҙи§Јзҡ„еә”з”Ё
ж•ҷжқҗзүҲжң¬пјҡеҢ–еӯҰ
иҜ•еҚ·еҲҶзұ»пјҡеҢ–еӯҰй«ҳдәҢдёҠеӯҰжңҹ
иҜ•еҚ·еӨ§е°Ҹпјҡ1.0 MB
ж–Ү件зұ»еһӢпјҡ.doc жҲ– .pdf жҲ– .zip
еҸ‘еёғж—¶й—ҙпјҡ2024-05-01
жҺҲжқғж–№ејҸпјҡе…Қиҙ№дёӢиҪҪ
дёӢиҪҪең°еқҖпјҡзӮ№жӯӨдёӢиҪҪ
д»ҘдёӢдёәиҜ•еҚ·йғЁеҲҶиҜ•йўҳйў„и§Ҳ
| 1. еҚ•йҖүйўҳ | |
|
дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . KspеҸӘдёҺйҡҫжә¶з”өи§ЈиҙЁзҡ„жҖ§иҙЁе’Ңжё©еәҰжңүе…і
B . з”ұдәҺKsp(ZnS)пјһKsp(CuS)пјҢжүҖд»ҘZnSжІүж·ҖеңЁдёҖе®ҡжқЎд»¶дёӢеҸҜиҪ¬еҢ–дёәCuSжІүж·Җ
C . е…¶д»–жқЎд»¶дёҚеҸҳпјҢзҰ»еӯҗжө“еәҰж”№еҸҳж—¶пјҢKspдёҚеҸҳ
D . дёӨз§Қйҡҫжә¶з”өи§ЈиҙЁдҪңжҜ”иҫғж—¶пјҢKspе°Ҹзҡ„пјҢжә¶и§ЈеәҰдёҖе®ҡе°Ҹ
|
|
| 2. е®һйӘҢжҺўз©¶йўҳ | |||||||||||||
|
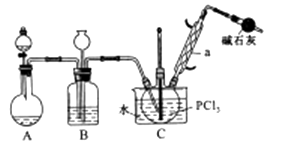
дёүж°Ҝж°§зЈ·(POCl3)жҳҜйҮҚиҰҒзҡ„еҹәзЎҖеҢ–е·ҘеҺҹж–ҷпјҢе№ҝжіӣз”ЁдәҺеҲ¶иҚҜгҖҒжҹ“еҢ–гҖӮеЎ‘иғ¶еҠ©еүӮзӯүиЎҢдёҡгҖӮжҹҗе…ҙи¶Је°Ҹз»„жЁЎжӢҹPCl3зӣҙжҺҘж°§еҢ–жі•еҲ¶еӨҮPOCl3 пјҢ е®һйӘҢиЈ…зҪ®и®ҫи®ЎеҰӮдёӢпјҡ
жңүе…ізү©иҙЁзҡ„йғЁеҲҶжҖ§иҙЁеҰӮдёӢиЎЁпјҡ
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
|
|||||||||||||
| 3. е®һйӘҢжҺўз©¶йўҳ | |
|
ж°ўж°”дҪңдёәжё…жҙҒиғҪжәҗжңүзқҖе№ҝжіӣзҡ„еә”з”ЁеүҚжҷҜпјҢеҗ«зЎ«еӨ©з„¶ж°”еҲ¶еӨҮж°ўж°”зҡ„жөҒзЁӢеҰӮдёӢгҖӮ
 иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ IпјҺиҪ¬еҢ–и„ұзЎ«пјҡе°ҶеӨ©з„¶ж°”еҺӢе…Ҙеҗёж”¶еЎ”пјҢ30в„ғж—¶пјҢеңЁTпјҺFиҸҢдҪңз”ЁдёӢпјҢй…ёжҖ§зҺҜеўғдёӯи„ұзЎ«иҝҮзЁӢзӨәж„ҸеӣҫеҰӮдёӢгҖӮ 
|
|
| 4. еҚ•йҖүйўҳ | |
|
еңЁеҗ«жңүжө“еәҰеқҮдёә0.01molвҖўL-1зҡ„Cl-гҖҒBr-гҖҒI-зҰ»еӯҗзҡ„жә¶ж¶ІдёӯпјҢзј“ж…ўеҠ е…ҘAgNO3зЁҖжә¶ж¶ІпјҢжһҗеҮәдёүз§ҚжІүж·Җзҡ„е…ҲеҗҺйЎәеәҸжҳҜпјҲ пјү
A . AgClгҖҒAgBrгҖҒAgI
B . AgIгҖҒAgBrгҖҒAgCl
C . AgBrгҖҒAgClгҖҒAgI
D . дёүз§ҚжІүж·ҖеҗҢж—¶жһҗеҮә
|
|
| 5. еҚ•йҖүйўҳ | |
|
е·ІзҹҘпјҡpAg=пјҚlgc(Ag+)пјҢKsp(AgCl)=1Г—10пјҚ12 пјҢ Ksp (AgI)=1Г—10пјҚ16гҖӮеҰӮеӣҫжҳҜеҗ‘10mLAgNO3жә¶ж¶ІдёӯйҖҗж»ҙж»ҙе…Ҙ0.1mo1В·LпјҚ1зҡ„NaClжә¶ж¶Іж—¶пјҢpAgйҡҸзқҖеҠ е…ҘNaClжә¶ж¶Ізҡ„дҪ“з§ҜеҸҳеҢ–зҡ„еӣҫеғҸ(е®һзәҝ)гҖӮдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲпјү
A . еҺҹAgNO3жә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә0.1molВ·LпјҚ1
B . еӣҫдёӯxзӮ№иЎЁзӨәжә¶ж¶ІдёӯAg+жҒ°еҘҪе®Ңе…ЁжІүж·Җ
C . еӣҫдёӯxзӮ№зҡ„еқҗж Үдёә(10пјҢ6)
D . иӢҘжҠҠNaClжә¶ж¶ІжҚўжҲҗ0.1molВ·LпјҚ1NaIжә¶ж¶ІпјҢеҲҷеӣҫеғҸеңЁз»ҲзӮ№еҗҺеҸҳдёәиҷҡзәҝйғЁеҲҶ
|
|
| 6. еҚ•йҖүйўҳ | |
|
tв„ғж—¶пјҢдёӨз§Қзўій…ёзӣҗMCO3пјҲMиЎЁзӨәX2+жҲ–Y2+пјүзҡ„жІүж·Җжә¶и§Је№іиЎЎжӣІзәҝеҰӮеӣҫжүҖзӨәгҖӮе·ІзҹҘпјҡ
 пјҢ пјҢ  пјҢ пјҢ  гҖӮ гҖӮ дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . зәҝaиЎЁзӨәYCO3зҡ„жә¶и§Је№іиЎЎжӣІзәҝ
B .
 C . tв„ғж—¶пјҢеҗ‘XCO3жӮ¬жөҠж¶ІдёӯеҠ е…ҘйҘұе’Ң
C . tв„ғж—¶пјҢеҗ‘XCO3жӮ¬жөҠж¶ІдёӯеҠ е…ҘйҘұе’Ң  жә¶ж¶ІпјҢеҸҜиғҪжңүYCO3з”ҹжҲҗ
D . tв„ғж—¶пјҢеҗ‘йҘұе’ҢYCO3жә¶ж¶ІдёӯеҠ е…ҘNa2CO3жә¶ж¶ІпјҢдёҖе®ҡиғҪдә§з”ҹYCO3жІүж·Җ жә¶ж¶ІпјҢеҸҜиғҪжңүYCO3з”ҹжҲҗ
D . tв„ғж—¶пјҢеҗ‘йҘұе’ҢYCO3жә¶ж¶ІдёӯеҠ е…ҘNa2CO3жә¶ж¶ІпјҢдёҖе®ҡиғҪдә§з”ҹYCO3жІүж·Җ
|
|
| 7. еҚ•йҖүйўҳ | |
|
дёӢеҲ—жңүе…іжІүж·Җжә¶и§Је№іиЎЎзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ( )
A . жҹҗзҰ»еӯҗиў«жІүж·Җе®Ңе…ЁжҳҜжҢҮиҜҘзҰ»еӯҗеңЁжә¶ж¶Ідёӯзҡ„жө“еәҰдёә0
B . еңЁAglзҡ„жІүж·Җжә¶и§Је№іиЎЎдҪ“зі»дёӯпјҢеҠ е…ҘK2SеӣәдҪ“пјҢAglжІүж·ҖеҸҜиҪ¬еҢ–дёәAg2SжІүж·Җ
C . еңЁAgClзҡ„жІүж·Җжә¶и§Је№іиЎЎдҪ“зі»дёӯпјҢеҠ е…Ҙи’ёйҰҸж°ҙпјҢAgClзҡ„KaPеўһеӨ§
D . еңЁCaCO3зҡ„жІүж·Җжә¶и§Је№іиЎЎдҪ“зі»дёӯпјҢйҖҡе…ҘCO2ж°”дҪ“пјҢжә¶и§Је№іиЎЎдёҚ移еҠЁ
|
|
| 8. еҚ•йҖүйўҳ | |||||||||||||
|
дёҖе®ҡжё©еәҰдёӢзҡ„йҡҫжә¶з”өи§ЈиҙЁAmBnеңЁж°ҙжә¶ж¶ІдёӯиҫҫеҲ°жІүж·Җжә¶и§Је№іиЎЎж—¶пјҢе…¶е№іиЎЎеёёж•°Ksp = cm(An+)В·cn(BmвҲ’)пјҢз§°дёәйҡҫжә¶з”өи§ЈиҙЁзҡ„жә¶еәҰз§ҜгҖӮе·ІзҹҘдёӢиЎЁж•°жҚ®пјҡ
еҜ№еҗ«зӯүзү©иҙЁзҡ„йҮҸзҡ„CuSO4гҖҒFeSO4гҖҒFe2(SO4)3зҡ„ж··еҗҲжә¶ж¶Ізҡ„иҜҙжі•пјҢдёҚ科еӯҰзҡ„жҳҜпјҲ пјү
A . еҗ‘иҜҘж··еҗҲжә¶ж¶ІдёӯйҖҗж»ҙеҠ е…ҘNaOHжә¶ж¶ІпјҢжңҖе…ҲзңӢеҲ°зәўиӨҗиүІжІүж·Җ
B . иҜҘжә¶ж¶Ідёӯc(SO42вҲ’)вҲ¶[c(Cu2+)+c(Fe2+)+ c(Fe3+)]пјһ5вҲ¶4
C . еҗ‘иҜҘжә¶ж¶ІдёӯеҠ е…ҘйҖӮйҮҸж°Ҝж°ҙпјҢ并и°ғиҠӮpHеҲ°3гҖң4еҗҺиҝҮж»ӨпјҢеҸҜиҺ·еҫ—зәҜеҮҖзҡ„CuSO4жә¶ж¶І
D . еңЁpH=5зҡ„жә¶ж¶ІдёӯFe3+дёҚиғҪеӨ§йҮҸеӯҳеңЁ
|
|||||||||||||
| 9. з»јеҗҲйўҳ | |||||||||
|
дёӢиЎЁжҳҜ25в„ғж—¶дёүз§Қејұй…ёзҡ„з”өзҰ»е№іиЎЎеёёж•°
|
|||||||||
| 10. еҚ•йҖүйўҳ | |
|
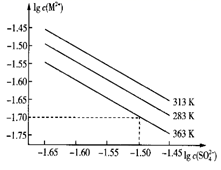
жҹҗзЎ«й…ёзӣҗеңЁж°ҙдёӯзҡ„жІүж·Җжә¶и§Је№іиЎЎжӣІзәҝеҰӮдёӢ(M2+д»ЈиЎЁ+2д»·йҮ‘еұһзҰ»еӯҗ)гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ( )
A . 363 Kж—¶пјҢиҜҘзЎ«й…ёзӣҗзҡ„жә¶еәҰз§ҜKspзҡ„ж•°йҮҸзә§дёә10-3
B . жё©еәҰдёҖе®ҡж—¶жә¶еәҰз§ҜKspйҡҸc(
 )зҡ„еўһеӨ§иҖҢеҮҸе°Ҹ
C . 313 KдёӢзҡ„иҜҘзӣҗйҘұе’Ңжә¶ж¶ІеҚҮжё©еҲ°363 Kж—¶жңүеӣәдҪ“жһҗеҮә
D . 283 KдёӢзҡ„иҜҘзӣҗйҘұе’Ңжә¶ж¶ІеҚҮжё©еҲ°313 Kж—¶жңүеӣәдҪ“жһҗеҮә )зҡ„еўһеӨ§иҖҢеҮҸе°Ҹ
C . 313 KдёӢзҡ„иҜҘзӣҗйҘұе’Ңжә¶ж¶ІеҚҮжё©еҲ°363 Kж—¶жңүеӣәдҪ“жһҗеҮә
D . 283 KдёӢзҡ„иҜҘзӣҗйҘұе’Ңжә¶ж¶ІеҚҮжё©еҲ°313 Kж—¶жңүеӣәдҪ“жһҗеҮә
|
|
- жІіеҚ—зңҒеҚ—йҳіеёӮ2020-2021еӯҰе№ҙй«ҳдёүдёҠеӯҰжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•иҜ•еҚ·
- йҷ•иҘҝзңҒжёӯеҚ—еёӮеҜҢе№іеҺҝ2020-2021еӯҰе№ҙй«ҳдёҖдёӢеӯҰжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰиҜ•йўҳ
- жұҹиӢҸзңҒиӢҸе·һеёӮеҗҙжұҹеҢә2020-2021еӯҰе№ҙй«ҳдәҢдёҠеӯҰжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•иҜ•еҚ·
- зҰҸе»әзңҒжіүе·һеёӮ2021-2022еӯҰе№ҙй«ҳдёүдёҠеӯҰжңҹеҢ–еӯҰејҖеӯҰиҖғиҜ•иҜ•еҚ·
- е№ҝиҘҝжў§е·һеёӮ2021е№ҙй«ҳиҖғзҗҶз»ј-еҢ–еӯҰ3жңҲжЁЎжӢҹиҜ•еҚ·
- йҷ•иҘҝзңҒжұүдёӯеёӮ2021-2022еӯҰе№ҙй«ҳдёҖдёӢеӯҰжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҜ•йўҳ
- дёҠжө·еёӮй»„жөҰеҢә2021е№ҙй«ҳиҖғеҢ–еӯҰдәҢжЁЎиҜ•еҚ·
- еҶІеҲә2021й«ҳиҖғеҢ–еӯҰжҠјйўҳи®ӯз»ғпјҲдёғпјүз”өеҢ–еӯҰеҸҠе…¶еә”з”Ё
- й»‘йҫҷжұҹзңҒиҘҝеҢ—йғЁе…«ж Ў2021-2022еӯҰе№ҙй«ҳдёҖдёӢеӯҰжңҹжңҹдёӯиҒ”иҖғеҢ–еӯҰиҜ•йўҳ
- е№ҝиҘҝжҹіе·һеёӮ2021е№ҙй«ҳиҖғеҢ–еӯҰдёүжЁЎиҜ•еҚ·
- еӨ©жҙҘеёӮеҚ—ејҖеҢә2022еұҠй«ҳдёүжЁЎжӢҹиҖғиҜ•пјҲдәҢжЁЎпјүеҢ–еӯҰиҜ•йўҳ
- е№ҝиҘҝеЈ®ж—ҸиҮӘжІ»еҢәеҚ—е®ҒеёӮ2021е№ҙй«ҳиҖғеҢ–еӯҰдёҖжЁЎиҜ•еҚ·





 гҖҒHCO
гҖҒHCO  еңЁж°ҙдёӯз»“еҗҲH+зҡ„иғҪеҠӣз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёәгҖӮ
еңЁж°ҙдёӯз»“еҗҲH+зҡ„иғҪеҠӣз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёәгҖӮ