广东省陆丰市2018年11月高三第一次调研理综 (化学部分)
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A . 标准状况下,2.24LSO3中含有0.1NA个SO3分子
B . 向1L的密闭容器中充入46gNO2气体,容器中气体的分子数为NA
C . 常温下,将2.7g铝片投入足量的浓硫酸中,转移电子的数目为0.3NA
D . 常温常压下,7.0g由丁烯与丙烯组成的混合气体中含有的氢原子数目为NA
|
|
| 2. 单选题 | |
|
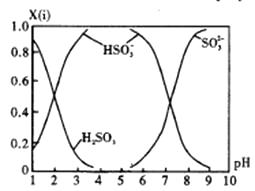
短周期主族元素a、b、c、d原子序数依次增大,b元素的一种同位素可用于考古年代鉴定。甲、乙分别是元素b、d的单质,通常甲为固体,乙为气体,0.001mol/L的丙溶液pH=3;W、X、Y均是由这些元素构成的二元化台物,Y是形成酸雨的主要物质之一。上述物质的转化关系如图,下列说法正确的是( )
A . 原子半径:b
B . a、c、d形成的化台物一定是共价化合物
C . W、X、Y中X的熔沸点最高
D . Y、Z均可用排水法收集
|
|
| 3. 综合题 | |||||||||
|
“绿水青山就是金山银山”,研究NO2、NO、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
|
|||||||||
| 4. 单选题 | |
|
用甲醇燃料电池作电源,用铁作电极电解含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而除去,装置如下图。下列说法正确的是( )
A . Fe(II)为阳极
B . M电极的电极反应式为CH3OH+8OH--6e-= CO32-+6H2O
C . 电解一段时间后,在Fe(Ⅰ)极附近有沉淀析出
D . 电路中每转移6mol电子,最多有1 mol Cr2O72-被还原
|
|
| 5. 综合题 | |
|
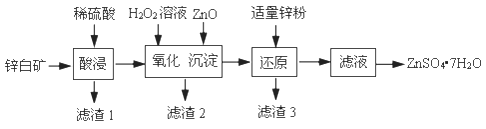
硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有FeO、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
已知:Ksp[Fe(OH)3]=4.0×10−38 , Ksp[Cu(OH)2]=2.2×10−20
|
|
| 6. 单选题 | |
|
下列关于有机化合物的说法正确的是( )
A . 制备聚四氟乙烯的单体属于不饱和烃
B . 分子式为C4H10O的醇有4种同分异构体
C . 苯乙烯(
|
|
| 7. 单选题 | |
|
已知298K时,Ksp(NiS)=1.0×10-21 , Ksp(NiCO3)=1.0×10-7 ;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是( )
A . 常温下NiCO3的溶解度大于NiS的溶解度
B . 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C . 对于曲线I,在b点加热,b点向c点移动
D . P为3.5且对应的阴离子是CO32-
|
|
| 8. 综合题 | |
|
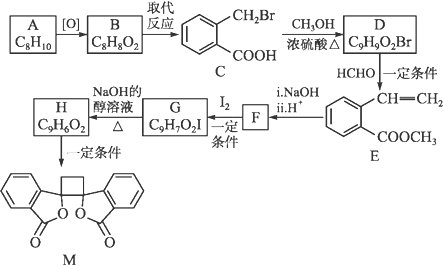
具有抗菌作用的白头翁素衍生物M的合成路线如下图所示:
已知:ⅰ.RCH2Br ⅱ.R—HC=CH—R' ⅲ.R—HC=CH—R'
|
|
| 9. 单选题 | |
|
化学与生活密切相关。下列说法错误的是
A . 泡沫灭火器可用于一般的起火,也适用于电器起火
B . 疫苗一般应冷藏存放,以避免蛋白质变性
C . 家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D . 电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
|
|
| 10. 综合题 | |||||||||||||
|
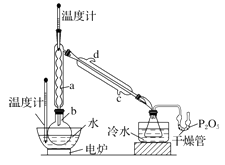
硼酸三甲酯用作柠檬类水果的熏蒸剂。实验室合成硼酸三甲酯的原理及装置如下:
Na2B4O7·10H2O+2H2SO4+16CH3OH 实验步骤如下: ①在圆底烧瓶中加入44.8 g 甲醇和19.1gNa2B4O7·10H2O (硼砂,式量为382),然后缓慢加入浓H2SO4 并振荡;加热烧瓶中的液体;通过分馏柱回流一段时间。 ②先接收51~55℃的馏分,再接收55~60℃的馏分。 ③将两次馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离。 ④精馏得高纯硼酸三甲酯19.2 g。 回答下列问题:
|
|||||||||||||
- 高中化学人教版(2019)选择性必修1第一章第一节 反应热
- 高中化学人教版(2019)选择性必修1第一章第二节 反应热的计算
- 高中化学人教版(2019)选择性必修1第二章第一节 化学反应速率
- 高中化学人教版(2019)选择性必修1第二章第二节 化学平衡
- 高中化学人教版(2019)选择性必修1第二章第三节第四节(两节合一)
- 北京市大兴区2021-2022学年高二上学期期中考试化学试题
- 福建省福州市八县(市)协作校2021-2022学年高二上学期期中联考化学试题
- 福建省三明市教研联盟校2021-2022学年高二上学期期中联考化学试题
- 江苏省常熟市2021-2022学年高二上学期期中考试化学试题
- 江苏省淮安市高中校协作体2021-2022学年高二上学期期中考试化学(选修)试题
- 江苏省宿迁市沭阳县2021-2022学年高二上学期期中调研测试化学试题
- 江苏省徐州市2021-2022学年高二上学期期中考试化学试题

 CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为


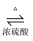 2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O



