高中化学人教版(2019)选择性必修1第一章第二节 反应热的计算
高中化学人教版(2019)选择性必修1第一章第二节 反应热的计算
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 综合题 | |
|
2SO2(g)+O2(g)⇌2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3放出的热量99kJ.请回答下列问题:
|
|
| 2. 单选题 | |
|
根据下列热化学方程式:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol ②H2(g)+ ③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH3=-870.3 kJ/mol 可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
A . ΔH=+244.1 kJ/mol
B . ΔH=-488.3 kJ/mol
C . ΔH=-996.6 kJ/mol
D . ΔH=+996.6 kJ/mol
|
|
| 3. 单选题 | |
|
已知在
 和 和 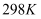 条件下, 条件下,  燃烧生成水蒸气放出 燃烧生成水蒸气放出  热量,下列热化学方程式正确的是( ) 热量,下列热化学方程式正确的是( )
A .
 ; ;  B .
B .  ; ;  C .
C .  ; ;  D .
D .  ; ; 
|
|
| 4. 综合题 | |
|
肼(
|
|
| 5. 单选题 | |
|
根据盖斯定律判断如下图所示的物质转变过程中,正确的等式是( )
A . ΔH1=ΔH2=ΔH3=ΔH4
B . ΔH1+ΔH2=ΔH3+ΔH4
C . ΔH1+ΔH2+ΔH3=ΔH4
D . ΔH1=ΔH2+ΔH3+ΔH4
|
|
| 6. 单选题 | |
|
已知反应:H2(g)+I2(g)
 2HI(g) ΔH=-14.8 kJ • mol-1。 2HI(g) ΔH=-14.8 kJ • mol-1。
则反应:HI(g)
A . -7.4 kJ • mol-1
B . +7.4 kJ • mol-1
C . -14.8 kJ • mol-1
D . +14.8kJ • mol-1
|
|
| 7. 单选题 | |
|
为消除NO对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体。
已知:① ② 则反应
A . +2.98kJ·mol-1
B . -2.98kJ·mol-1
C . +1807.98kJmol-1
D . -1807.98kJ·mol-1
|
|
| 8. 单选题 | |
|
将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s) + 2Cl2(g) = TiCl4(l) + O2(g) △H = +140.5 kJ/mol C(s,石墨) + 1/2O2(g) = CO(g) △H = -110.5 kJ/mol 则反应TiO2(s) + 2Cl2(g) + 2C(s,石墨) = TiCl4(l) + 2CO(g) 的△H 是( )
A . +80.5 kJ/mol
B . +30.0 kJ/mol
C . -30.0 kJ/mol
D . -80.5 kJ/mol
|
|
| 9. 单选题 | |
|
氢气和氧气反应生成水的能量关系如图所示:
下列说法正确的是( )
A . △H5<0
B . △H1>△H2+△H3+△H4
C . △H1+△H2+△H3+△H4+△H5=0
D . O-H键键能为△H1
|
|
| 10. 综合题 | |
|
|
高中化学 试卷推荐
- 贵州省遵义市2022届高三下学期三模理科综合化学试题
- 河南省联盟2022届高三下学期(5月)模拟考试理科综合化学试题
- 河南省豫南省级示范高中联盟2022届高三下学期考前模拟四理科综合化学试题
- 吉林省吉林市2022届高三下学期第四次调研测试理综化学试题
- 上海市松江区2022届高三等级考二模化学试题
- 四川省凉山州2022届高三下学期第三次诊断性检测理综化学试题
- 四川省雅安市2022届高三下学期第三次诊断性考试理综化学试题
- 高中化学人教版(2019)必修第一册第一章第一节 物质的分类及转化
- 高中化学人教版(2019)必修第一册第一章 第二节 离子反应
- 高中化学人教版(2019)必修第一册第一章第三节 氧化还原反应
- 高中化学人教版(2019)必修第一册第二章第一节 钠及其化合物
- 高中化学人教版(2019)必修第一册第二章第二节 氯及其化合物
最近更新

 O2(g)=H2O(l) ΔH2=-285.8 kJ/mol
O2(g)=H2O(l) ΔH2=-285.8 kJ/mol
 H2(g)+
H2(g)+  ∆H=+180.50kJ·mol-1
∆H=+180.50kJ·mol-1 ∆H=-905.48kJ·mol-1
∆H=-905.48kJ·mol-1 的∆H为( )
的∆H为( )



