2019年高考化学真题分类汇编专题10:物质结构与性质
2019年高考化学真题分类汇编专题10:物质结构与性质
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是( )
A . 冰表面第一层中,HCl以分子形式存在
B . 冰表面第二层中,H+浓度为5×10−3 mol·L−1(设冰的密度为0.9 g·cm−3)
C . 冰表面第三层中,冰的氢键网格结构保持不变
D . 冰表面各层之间,均存在可逆反应HCl
 H++Cl− H++Cl−
|
|
| 2. 综合题 | |||||||||||
|
【选修三:物质结构与性质】
在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题:
|
|||||||||||
| 3. 综合题 | |
|
【选修三:物质结构与性质】
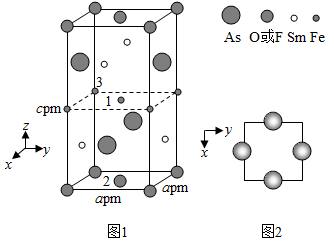
近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
|
|
| 4. 综合题 | |
|
【选修三:物质结构与性质】磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
|
|
| 5. 单选题 | |
|
反应NH4Cl+NaNO2=NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是( )
A . 中子数为18的氯原子:
 B . N2的结构式:N=N
C . Na+的结构示意图:
B . N2的结构式:N=N
C . Na+的结构示意图:  D . H2O的电子式:
D . H2O的电子式: |
|
| 6. 综合题 | |
|
A.[物质结构与性质]
Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu₂O。
|
|
高中化学 试卷推荐
- 浙江金华、温州、台州三市2015-2016学年高二下学期化学期中考试试卷
- 江西省新余市2019-2020学年高一下学期化学期末考试试卷
- 内蒙古通辽市科左后旗甘旗卡第二高级中学2019-2020学年高一下学期化学期末考试试卷
- 福建省宁德市2018-2019学年高三上学期化学期末考试试卷
- 青海省西宁市2019-2020学年高一下学期化学期末考试试卷
- 广西兴安县第三中学2019-2020学年高一下学期化学开学考试卷
- 备考2019年高考化学二轮专题 03 氧化还原反应
- 浙江省丽水市松阳县第二中学2019-2020学年高一下学期化学4月月考试卷
- 备考2018年高考化学一轮基础复习:专题29 化学实验仪器和基本操作
- 四川省阿坝州小金县中学2016-2017学年高二上学期化学期末考试试卷
- 2017_2018学年高中化学人教版选修三 课时训练5元素周期律
- 江西省上饶市广丰区2017-2018学年高一上学期化学期中考试试卷
最近更新


 ,
, 
 的空间构型为(用文字描述);Cu2+与OH−反应能生成[Cu(OH)4]2− , [Cu(OH)4]2−中的配位原子为(填元素符号)。
的空间构型为(用文字描述);Cu2+与OH−反应能生成[Cu(OH)4]2− , [Cu(OH)4]2−中的配位原子为(填元素符号)。