青海省海南州高级中学2022届高三摸底考试理科综合——化学
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生产、生活及社会发展密切相关。下列说法错误的是( )
A . 中国天眼的“眼眶”是钢铁结成的圈梁,属于新型无机非金属材料
B . “84"消毒液不能与洁厕灵混合使用
C . “N95”口罩所使用的熔喷布为聚丙烯,属于合成高分子材料
D . 我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是SiO2
|
|
| 2. 单选题 | |
|
下列关于2 -环已基丙烯(
A . 2 -苯基丙烯的分子式为C9H16
B . 2 -环己基丙烯分子中所有碳原子可能共平面
C . 二者均可发生缩聚反应和氧化反应
D . 2 -苯基丙烯的一氯代产物只有5种。
|
|
| 3. 单选题 | |
|
设N表示阿伏加德罗常数的值。下列说法正确的是( )
A . 14 g聚丙烯中含C一H键总数目为2NA
B . 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
C . 2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间
D . 电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA
|
|
| 4. 单选题 | |
|
某化学兴趣小组用如图所示装置检验Pb(NO3)2受热分解的产物(图中夹持和加热设备略去)。在试管中放人研碎的Pb(NO3)2晶体后,加热;实验结束后,试管中得到黄色粉末(PbO),U形管下部有少量液体X,集气瓶中收集到无色气体Y。下列说法错误的是( )
A . 液体X可能是液化的NO2或N2O4
B . 在装置中用锡纸将胶塞、胶管与产生的气体隔开,主要是为了防止其被生成的气体腐蚀
C . 气体Y可能是O2 , 也可能是NO2与水反应后生成的NO
D . 停止反应,应注意先把导气管移出水面,然后熄灭火焰
|
|
| 5. 单选题 | |
|
某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍;W的最高价氧化物对应的水化物具有两性,W、X.Y三种简单离子的核外电子排布相同。下列说法正确的是( )
A . X与Y、Y与Z均可形成X2Y2、Z2Y2型化合物
B . 离子半径:X>W>Y>Z
C . X、Y、Z组成的化合物中只含有离子键
D . 常温常压下熔点:X2Y<Z2Y
|
|
| 6. 单选题 | |
|
元素钒在溶液中有多种存在形式,比如:V2+ (紫色)、V3+ (绿色)、VO3+ (蓝色)、
 (黄色)等。钒液可充电电池的工作原理如图所示。已知充电时,左槽溶液颜色由蓝色逐渐变为黄色,溶液中c(H+ )=1.0 mol·L-1 , 阴离子为 (黄色)等。钒液可充电电池的工作原理如图所示。已知充电时,左槽溶液颜色由蓝色逐渐变为黄色,溶液中c(H+ )=1.0 mol·L-1 , 阴离子为 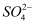 。下列说法错误的是( ) 。下列说法错误的是( )
A . a极为电池的正极
B . 充电时,阳极电极反应式为VO2++H2O-e-=
 +2H+
C . 放电过程中,右槽溶液颜色由紫色变为绿色
D . 放电时,电子由C2极流出经交换膜流向C1极 +2H+
C . 放电过程中,右槽溶液颜色由紫色变为绿色
D . 放电时,电子由C2极流出经交换膜流向C1极
|
|
| 7. 单选题 | |
|
常温下,向20 mL0.01 mol·L-1的NaOH溶液中逐滴加人0.01 mol·L-1的CH3COOH溶液,溶液中由水电离出的c水(OH-)的对数随加人CH3COOH溶液体积的变化如图所示,下列说法正确的是( )
A . H、F点溶液显中性
B . E点溶液中由水电离的c水(OH-)=1×10-3 mol·L-1
C . H点溶液中离子浓度关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D . G点溶液中各离子浓度关系为c(CH3COO-)=c(Na+)+c(H+)-c(OH-)
|
|
| 8. 综合题 | |
|
三氯化氮(NCl3)是一种强氧化剂,工业上可用于漂白和消毒,实验室可由氯气通入碳酸铵溶液中制得。某化学小组利用此原理进行实验室制备三氯化氮。
回答下列问题:
|
|
| 9. 综合题 | |||||||||||||
|
由废铅蓄电池的铅膏采用氯盐法制备PbCl2的工艺流程如下:
已知:①铅膏的组成如下表:
②PbCl2是白色结晶性粉末,微溶于冷水,易溶于热水、浓盐酸和氢氧化钠溶液。 回答下列问题:
|
|||||||||||||
| 10. 综合题 | |
|
SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
|
|
- 北京市大兴区2020-2021学年高一上学期期末考试化学试题
- 陕西省渭南市大荔县2020-2021学年高一下学期期末考试化学试题
- 上海松江区2021-2022学年高三上学期期末考试化学试题
- 黑龙江省齐齐哈尔市2022届高三第二次模拟考试理科综合化学试题
- 河北省唐山市2022届高三普通高中学业水平选择性考试第二次模拟演练化学试题
- 河北省衡水中学2020-2021学年高三上学期化学期中考试试卷
- 四川省成都市2020-2021学年高二上学期期末调考化学试题
- 山西省沁源县第一中学2020-2021学年高二下学期化学开学考试试卷
- 湖北省十堰市2021年高考化学4月模拟试卷
- 山东省滨州市2022届高三第二次模拟考试化学试题
- 河北省唐山市2021年高考化学三模试卷
- 江苏省启东市2020-2021学年高三上学期化学期中考试试卷



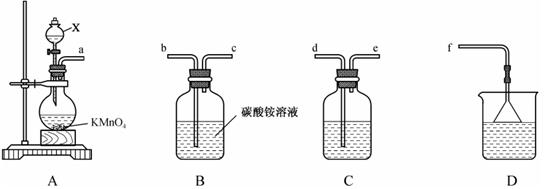


 的离子方程式为。
的离子方程式为。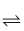 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1 



