2016年广东省深圳市高考化学二模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也.”这里所用的“法”是指( )
A . 萃取
B . 渗析
C . 蒸馏
D . 干馏
|
|
| 2. 单选题 | |
|
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A . 30 g乙烷中所含的极性共价键数为7NA
B . 标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA
C . 1 L浓度为1 mol•L﹣1的 H2O2水溶液中含有的氧原子数为2NA
D . MnO2和浓盐酸反应生成1 mol氯气时,转移的电子数为2NA
|
|
| 3. 单选题 | |
|
EDTA是一种重要的络合剂.4mol 一氯乙酸和1mol乙二胺(
A . C10H16N2O8
B . C10H20N2O8
C . C8H16N2O8
D . C16H20N2O8Cl
|
|
| 4. 单选题 | ||||||||||||||||
|
下列实验中,操作和现象以及对应结论都正确且现象与结论具有因果关系的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 5. 单选题 | |
|
一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示.下列说法错误的是( )
A . 电池的正极反应为H2O2+2e﹣=2OH﹣
B . 电池放电时Na+从a极区移向b极区
C . 电子从电极b经外电路流向电极a
D . b极室的输出液经处理后可输入a极室循环利用
|
|
| 6. 单选题 | |
|
短周期主族元素W,X,Y,Z的原子序数依次增大.W,Z同族,Y,Z相邻,W,Y,Z三种元素原子的最外层电子数之和为11,X原子最外层电子数等于最内层电子数的一半.下列叙述正确的是( )
A . 金属性:X<Y
B . 原子半径:Y>Z
C . 最简单氢化物的热稳定性:Z>W
D . Y元素氧化物不溶于X元素最高价氧化物对应水化物的水溶液
|
|
| 7. 单选题 | |
|
25℃时,向100mL 0.1mol•L﹣1 NH4HSO4溶液中滴加0.1mol•L﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸).下列说法错误的是( )
A . a点时溶液的pH<1
B . c点时离子浓度大小顺序为:c(Na+)>c(SO42﹣)>c(NH4+)
C . de段上的点均满足关系式:c(NH4+)+c(Na+)>2c(SO42﹣)
D . a点到b点的过程中,溶液的导电能力增强
|
|
| 8. 实验探究题 | |
|
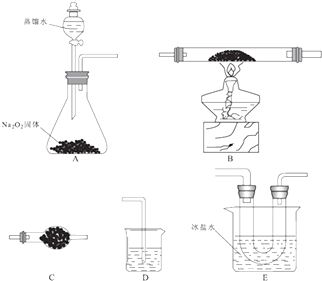
已知氯化亚铁的熔点674℃、沸点1023℃;三氯化铁在300℃以上易升华,易溶于水并且有强烈的吸水性.在500℃条件下氯化亚铁与氧气可能发生多种反应,反应之一为:12FeCl2+3O2
 2Fe2O3+8FeCl3 . 某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究.回答下列问题: 2Fe2O3+8FeCl3 . 某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究.回答下列问题:
|
|
| 9. 综合题 | |||||||||||||
|
不锈钢表面用硝酸和氢氟酸的混酸处理后,产生的酸洗废液中含有Fe3+、Ni2+、NO3﹣、F﹣和+6价铬的含氧酸根离子等.如图是综合利用该酸洗废液的工艺流程:
已知: ①金属离子开始沉淀和沉淀完全时的pH:
②Ni2+与足量氨水的反应为:Ni2++6NH3⇌[Ni(NH3)6]2+
|
|||||||||||||
| 10. 综合题 | |||||||||||||||||||||||||||||||||||
|
氮的化合物在生产生活中广泛存在.
|
|||||||||||||||||||||||||||||||||||
- 人教版高中化学选修五 第五章第二节:应用广泛的高分子材料
- 浙南名校联盟2019-2020学年高三上学期化学第一次联考试卷
- 2015-2016学年山东省德州市高三上学期期末化学试卷
- 四川省雅安市2019-2020学年高一下学期化学期末考试试卷
- 山东省枣庄市2019-2020学年高二下学期化学期末考试试卷
- 陕西省西安电子科技大学附属中学2019-2020学年高一上学期化学第二次月考试卷
- 陕西省宝鸡市岐山县2016-2017学年高二上学期化学期末考试试卷(理科)
- 2016-2017学年河南省信阳市高一下学期期中化学试卷
- 山西省太原市2015-2016学年高二上学期文科化学期末考试试卷
- 山东省聊城市2019-2020学年高二下学期化学期末考试试卷
- 人教版化学高二选修2第一单元课题3纯碱的生产同步练习
- 2018年高考理综化学真题试卷(天津卷)