备考2018年高考化学二轮专题复习 专题十四:实验综合
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 填空题 | |
|
I.氮是动植物生长不可缺少的元素,含氮化合物是重要的化工原料,研究CO、NOX等大气污染气体的处理具有重要意义.
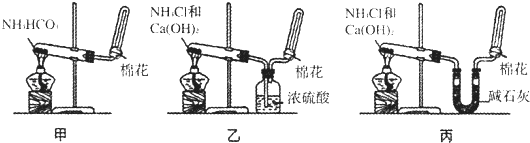
(1)下列过程没有起到氮的固定作用的是 (填选项). A.N2与O2反应生成NO B.NH3经催化氧化生成NO C.N2和H2在一定条件下合成氨D.豆科植物的根瘤菌将空气中氮气转化为含氮化合物 (2)实验室里可以选择下列实验装置中的 (填选项)制取氨气.
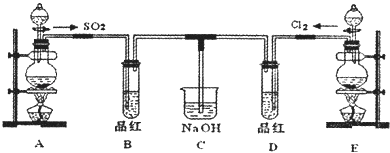
写出实验室制取氨气的化学方程式 ,检验氨气是否收集满的方法除用湿润的红色石蕊试纸以外还可以用 . II.某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.
(1)实验中用装置E制备Cl2 , 该反应的化学方程式为: ;若有6mol的HCl参加反应,则转移的电子的物质的量为 . (2)①反应开始一段时间后,观察到B、D两个试管中的晶红溶液出现的现象分别是:B ,D . ②停止通气后,再将B、D两个试管分别加热,两个试管中的现象分别是: B ,D . (3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定 会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请结合离子方程式说明产生该现象的原因: . |
|
| 2. 填空题 | |
|
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验.
请回答下列问题: (1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 . (2)实验过程中,装置B、C中发生的现象分别是 、 ,装置B中发生反应的离子方程式为 ; (3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 . (4)尾气可采用 溶液吸收. |
|
| 3. 填空题 | |
|
某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
(1)实验室常用装置E制备Cl2 , 指出该反应中浓盐酸所表现出的性质 , (2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为: B D (3)装置C的作用是 (4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅,试根据该实验装置和两名同学的实验结果 ①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸的两个目的 、 . ②试分析甲同学实验过程中,品红溶液不褪色的原因是: 、 ,并用离子方程式表示 ③你认为乙同学是怎样做到让品红溶液变得越来越浅的? . |
|
| 4. 综合题 | ||||||||||||||||||||||
|
用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.
|
||||||||||||||||||||||
| 5. 综合题 | |
|
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3 , 进而生产出纯碱.有关反应的化学方程式为:
NH3+CO2+H2O=NH4HCO3; NH4HCO3+NaCl=NaHCO3↓+NH4Cl; 2NaHCO3
|
|
| 6. 综合题 | |||||||||||||||||||||
|
单晶硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450﹣500℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.
查阅相关资料获悉: a.四氯化硅遇水极易水解; b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物; c.有关物质的物理常数见下表:
请回答下列问题:
|
|||||||||||||||||||||
| 7. 单选题 | ||||||||||||||||
|
下列操作不能达到目的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 8. 实验探究题 | |
|
醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂,实验室中以锌粒,三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒,已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g) 2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq) 2Cr2+(aq)+4CH3COO﹣(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)
请回答下列问题:
|
|
| 9. 实验探究题 | |||||||||||||
|
利用如图装置制取ClO2 , 并以ClO2为原料制备亚氯酸钠(NaClO2是一种高效氧化剂、漂白剂).已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl.
完成下列填空:
|
|||||||||||||
| 10. 实验探究题 | |
|
氢化钙(CaH2)固体是登山运动员常用的能源提供剂.氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气,氢化钙在一定条件下与氧气反应生成的产物不只一种.氢化钙通常用氢气与金属钙加热制取,如图1是模拟制取装置.
请回答下列问题:
|
|
- 天津市红桥区2016-2017学年高二下学期化学期末考试试卷
- 北京市西城区2017-2018学年高考理综-化学一模考试试卷(4月)
- 2019年高考理综化学真题试卷(天津卷)
- 山西省太原市2016-2017学年高一上学期化学期末考试试卷
- 安徽省黄山市2019-2020学年高二上学期期末质量检测化学(理)试题
- 高中化学人教版(2019)选择性必修1第四章第二节电解池
- 天津市和平区2016-2017学年高二上学期化学期末考试试卷
- 吉林省长春市第二十中学2019-2020学年高二下学期化学期末考试试卷
- 2016-2017学年四川省眉山中学高一上学期期中化学试卷
- 人教版化学高二选修1第四章第二节爱护水资源同步练习
- 江苏省镇江市2019-2020学年高一下学期化学期末考试试卷
- 浙江省丽水四校联考2019-2020学年高一上学期化学9月月考试卷






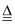 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O




 ≈4,lg2≈0.3】
≈4,lg2≈0.3】





