新疆克拉玛依市2021届高三第三次模拟检测理综化学试题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
明代《造强水法》记载“绿矾五斤,硝五斤,将矾炒去,约折五分之一,将二味同研细,锅下起火,取气冷定,开坛则药化为水。用水入五金皆成水,惟黄金不化水中。”文中的“硝”即硝酸钾。下列说法错误的是( )
A . “绿矾”的成分为FeSO4
B . “研细”可在研钵中进行
C . “开坛则药化为水”,“水”的主要成分是硝酸
D . “五金皆成水”,发生氧化还原反应
|
|
| 2. 单选题 | |
|
有一固体由Na2CO3、NaCl、CaCl2、CuSO4中的一种或几种物质组成,为检验此混合物的组成,进行如下实验:①将少量固体混合物溶于水搅拌后,得无色透明溶液;②在上述溶液中滴加硝酸钡溶液,有白色沉淀生成;③过滤,在白色沉淀中加入过量稀硝酸,沉淀全部溶解。根据实验现象可判断其组成可能为( )
A . NaCl、CaCl2
B . Na2CO3、CaCl2
C . Na2CO3、NaCl
D . CaCl2、CuSO4
|
|
| 3. 单选题 | |
|
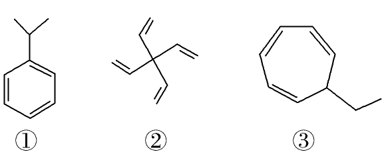
以下三种物质的分子式均为C9H12。下列说法正确的是( )
A . ①不能使高锰酸钾溶液褪色
B . ②的一氯代物只有2种
C . ③与苯互为同系物
D . ①和②分子中所有碳原子均可处于同一平面
|
|
| 4. 单选题 | |
|
雄黄(As4S4)具有驱虫解毒功效,雌黄(As2S3)是雄黄的伴生矿物,二者可以相互转化,转化过程如下,下列有关说法错误的是( )
A . H2O参加了该转化过程
B . 若1 mol雄黄发生Ⅱ反应转移28 mol电子,则a为SO3
C . 已知亚砷酸具有两性,Ⅳ反应是酸碱中和反应
D . As2O3是砒霜的主要成分,它是亚砷酸(H3AsO3)的酸酐
|
|
| 5. 单选题 | |
|
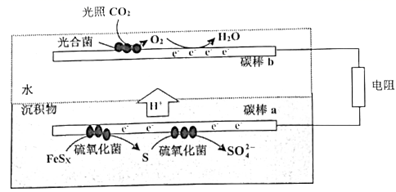
沉积物微生物燃料电池可处理含硫废水,其工作原理如图所示。下列说法错误的是( )
A . 碳棒b的电极反应式为:O2+4e-+4H+=2H2O
B . 光照强度对电池的输出功率有影响
C . 外电路的电流方向:碳棒a→碳棒b
D . 酸性增强不利于菌落存活,故工作一段时间后,电池效率降低
|
|
| 6. 单选题 | |
|
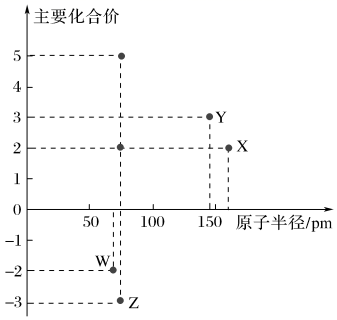
几种短周期元素的原子半径及主要化合价如图所示,下列叙述错误的是( )
A . X、Y的最高价氧化物都可以作耐火材料
B . Z的非金属性小于W
C . X的单质可分别与Z、W的单质发生氧化还原反应
D . Y的最高价氧化物对应的水化物既能溶于稀硫酸也能溶于稀氨水
|
|
| 7. 单选题 | |
|
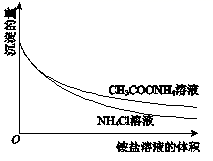
为了研究Mg(OH)2溶于铵盐溶液的原因,进行如下实验:
①向2mL 0.2mol/LMgCl2溶液中滴加1mol/LNaOH溶液至不再产生沉淀,将浊液分为2等份。 ②向一份中逐滴加入4mol/L NH4Cl溶液,另一份中逐滴加入4mol/L CH3COONH4溶液(pH≈7),边滴加边测定其中沉淀的量,沉淀的量与铵盐溶液的体积的关系如图。 ③将①中的NaOH溶液用氨水替换,重复上述实验。 下列说法错误的是( )
A . Mg(OH)2浊液中存在:Mg(OH)2(s)
 Mg2+(aq)+2OH﹣(aq)
B . ②中两组实验中均存在反应:Mg(OH)2+2NH4+=Mg2++2NH3•H2O
C . H+可能参与了NH4Cl溶液溶解Mg(OH)2的过程
D . ③中获得的图像与②相同 Mg2+(aq)+2OH﹣(aq)
B . ②中两组实验中均存在反应:Mg(OH)2+2NH4+=Mg2++2NH3•H2O
C . H+可能参与了NH4Cl溶液溶解Mg(OH)2的过程
D . ③中获得的图像与②相同
|
|
| 8. 综合题 | |
|
目前新能源技术被不断利用,高铁电池技术就是科研机构着力研究的一个方向。
|
|
| 9. 综合题 | |||||||
|
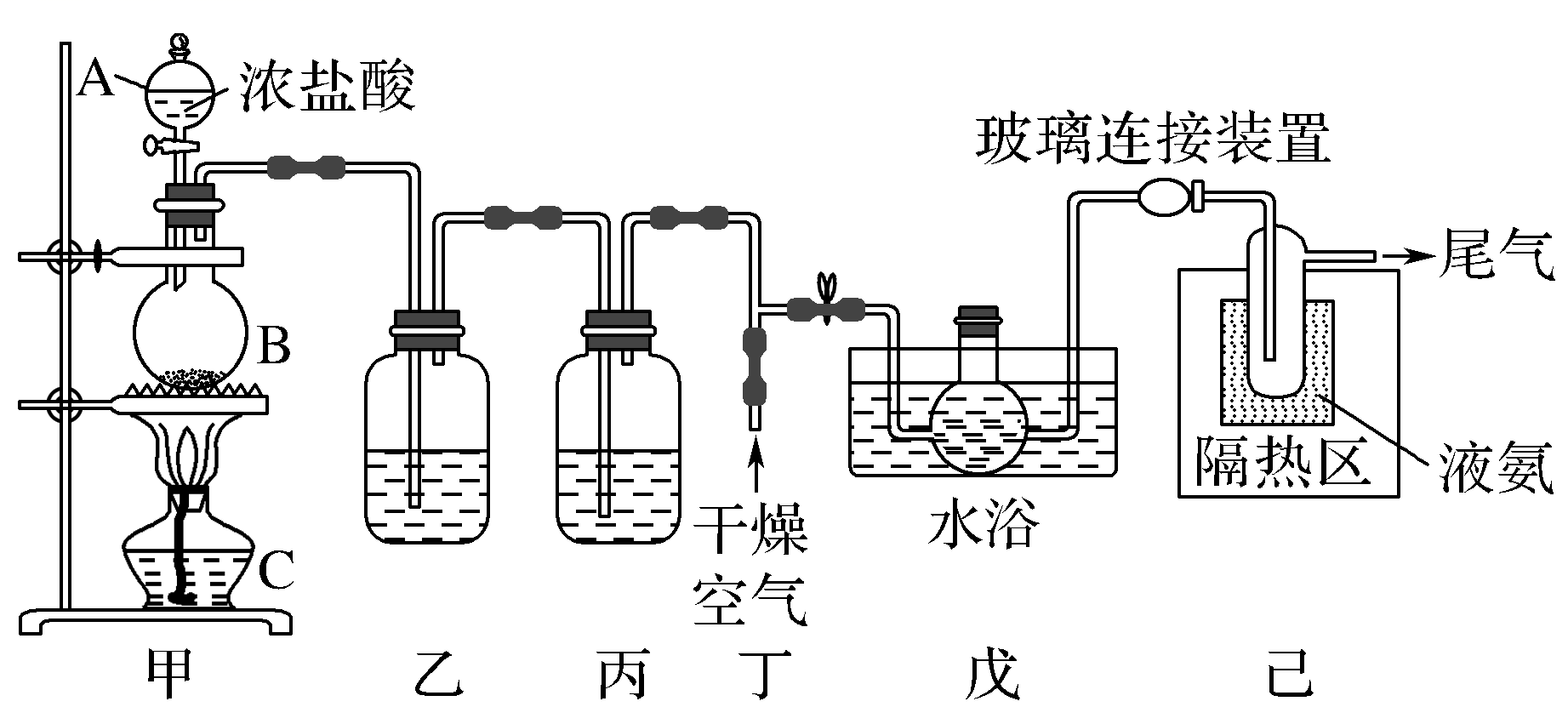
一氧化二氯(Cl2O)是一种氯化剂和氧化剂,黄棕色具有强烈刺激性气味,它易溶于水(1体积:100体积)同时反应生成次氯酸,遇有机物易燃烧或爆炸。利用如图装置可制备少量Cl2O。
已知Cl2O的部分性质如表:
回答下列问题:
|
|||||||
| 10. 综合题 | |||||||||||||||
|
以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
|
|||||||||||||||
- 河北省承德市联校2017-2018学年高三上学期化学期末考试试卷
- 人教高中化学一轮复习:专题8
- 人教版化学高二选修1第三章第二节金属的腐蚀和防护同步练习
- 江苏省宿迁市沭阳县2016-2017学年高一上学期化学期中考试试卷
- 湖北省仙桃、天门、潜江2019-2020学年高二下学期化学期末考试试卷
- 2015-2016学年内蒙古包头市包钢四中高一下学期期中化学试卷
- 浙江省台州市2019-2020学年高二下学期化学期末考试试卷
- 2017年浙江省金华市十校高考化学模拟试卷(9月份)
- 吉林省公主岭市2018-2019学年高一上学期化学期末考试试卷
- 2017年河北省保定市高考化学二模试卷
- 2015-2016学年浙江省杭州市高一下学期期末化学模拟试卷(押题卷)
- 人教版高中化学选修五 第三章第二节:醛

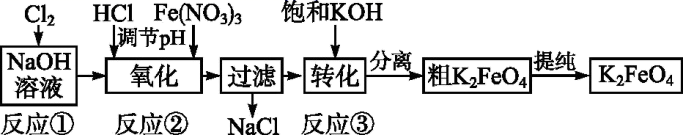
 +10H2O
+10H2O 4Fe(OH)3+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是。
4Fe(OH)3+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是。
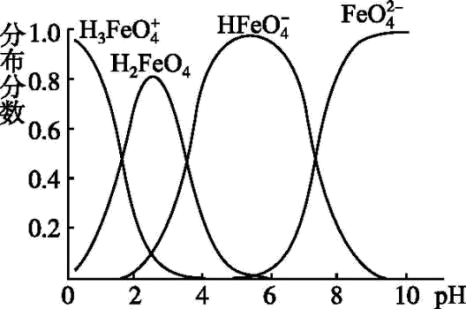
 的分布分数的变化情况是。
的分布分数的变化情况是。