2017_2018学年高中化学新人教版必修二 第二章 第三节 化学反应的速率和限度
2017_2018学年高中化学新人教版必修二 第二章 第三节 化学反应的速率和限度
教材版本:化学
试卷分类:化学高一下学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高一下学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 填空题 | |
|
反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1mol/(L•min)、②vC=0.5mol/(L•min)、③vB=0.5mol/(L•min),三种情况下该反应速率由大到小的关系是.(用序号表示)
|
|
| 2. 单选题 | |
|
反应SO2+O2
 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1 , 在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1 , 则这段时间为( ) 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1 , 在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1 , 则这段时间为( )
A . 0.1 s
B . 2.5 s
C . 5 s
D . 10 s
|
|
| 3. 单选题 | |
|
在一定条件下,将A2和B2两种气体通入1 L密闭容器中,反应按下式进行:x(A2)(g)+y(B2)(g)
 2C(g),2 s后测得反应速率如下:v(A2)=0.4 mol/(L·s),v(B2)=1.2 mol/(L·s),v(C)=0.8 mol/(L·s),则该x和y的值分别为( ) 2C(g),2 s后测得反应速率如下:v(A2)=0.4 mol/(L·s),v(B2)=1.2 mol/(L·s),v(C)=0.8 mol/(L·s),则该x和y的值分别为( )
A . 2和3
B . 3和2
C . 3和1
D . 1和3
|
|
| 4. 单选题 | |
|
向四个体积相同的密闭容器中分别充入一定量的SO2和O2 , 开始反应时,按反应速率由大到小的排列顺序正确的是( )
甲:500℃,10 mol SO2和5 mol O2反应 乙:500℃,V2O5作催化剂,10 mol SO2和5 mol O2反应 丙:450℃,8 mol SO2和5 mol O2反应 丁:500℃,8 mol SO2和5 mol O2反应
A . 甲、乙、丙、丁
B . 乙、甲、丙、丁
C . 乙、甲、丁、丙
D . 丁、丙、乙、甲
|
|
| 5. 填空题 | |
|
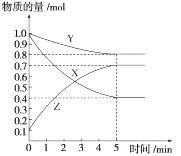
某温度下,在2 L密闭容器中,X、Y、Z三种气态物质发生化学反应时,物质的量随时间变化的关系曲线如图所示:
|
|
| 6. 填空题 | |
|
|
| 7. 单选题 | |
|
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
A . 加热
B . 不用稀硫酸,用98%浓硫酸
C . 滴加少量CuSO4溶液
D . 不用铁片,改用铁粉
|
|
| 8. 单选题 | |
|
下列反应中符合下列图像的是( )
A . N2(g)+3H2(g)
 2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
B . 2SO3(g) 2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
B . 2SO3(g)  2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
C . 4NH3(g)+5O2(g) 2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
C . 4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
D . H2(g)+CO(g) 4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
D . H2(g)+CO(g)  C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0) C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
|
|
| 9. 单选题 | |
|
下列叙述正确的是( )
A . △H>0的化学反应一定不能自发进行
B . 反应2NO2(g)
 N2O4(l)的熵(体系的混乱度)增大(即△S>0)
C . FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D . Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) N2O4(l)的熵(体系的混乱度)增大(即△S>0)
C . FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D . Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)  Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
|
|
| 10. 单选题 | |
|
在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是( ) CH3OH(g)+H2O(g)△H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是( )
A . 刚开始反应时速率:甲>乙
B . 平衡后反应放热:甲>乙
C . 500℃下该反应平衡常数:K=3×102
D . 若a≠0,则0.9<b<l
|
|
高中化学 试卷推荐
- 广东省佛山市2021-2022学年高二下学期7月期末教学质量检测化学试题
- 广东省广州市番禺区2021-2022学年高二下学期期末考试化学试题
- 广东省揭阳市2021-2022学年高二下学期期末考试化学试题
- 广东省茂名市2021-2022学年高二下学期期末教学质量监测化学试题
- 广东省梅州市2021-2022学年高二下学期期末联考化学试题
- 广东省清远市2021-2022学年高二下学期期末考试化学试题
- 广东省汕尾市2021-2022学年高二下学期全市教学质量监测化学试题
- 广东省韶关市2021-2022学年高二下学期期末考试化学试题
- 广东省肇庆市2021-2022学年高二下学期期末考试化学试题
- 广东省珠海市2020-2021学年高二下学期期末考试化学试题
- 广东省珠海市2021-2022学年高二下学期期末化学试题
- 广西北海市2021-2022学年高二下学期期末检测化学试题
最近更新