西藏拉萨市2021年高考化学一模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
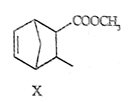
某有机化合物X的结构简式如图所示,下列说法错误的是( )
A . X中含有两种官能团
B . X能发生取代反应和加成反应
C . X的一氯代物有7种
D . X能使酸性
 溶液褪色 溶液褪色
|
|
| 2. 单选题 | |
|
化学与社会、生产、生活密切相关。下列说法正确的是( )
A . 碳纤维是一种新开发的合成有机高分子材料
B . 次氯酸具有强氧化性,可用于除去水中杂质
C . “雾霾”与“风雨雷电”一样属于一种自然现象
D . 漂白粉长期暴露在空气中,会变质甚至失效
|
|
| 3. 单选题 | |
|
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A . 常温下,pH=9的
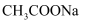 溶液中,水电离出的H+数目为10-5NA
B . 1molK2Cr2O7被还原为Cr3+转移的电子数目为6NA
C . 常温下2.24LN2中共用电子对数目为0.3NA
D . 1L0.1mol·L-1NH4Cl溶液中,NH 溶液中,水电离出的H+数目为10-5NA
B . 1molK2Cr2O7被还原为Cr3+转移的电子数目为6NA
C . 常温下2.24LN2中共用电子对数目为0.3NA
D . 1L0.1mol·L-1NH4Cl溶液中,NH  的数目为0.1NA 的数目为0.1NA
|
|
| 4. 单选题 | ||||||||||||||||
|
下列有关实验的操作正确的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 5. 单选题 | |
|
下列离子方程式正确的是( )
A . 金属铜与稀硝酸反应:3Cu+8H++2NO
 =3Cu2++2NO↑+4H2O
B . 氯化铁和铜反应:Fe3++Cu=Fe2++Cu2+
C . 硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++2H2O2+4H+=2Fe3++4H2O
D . 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO =3Cu2++2NO↑+4H2O
B . 氯化铁和铜反应:Fe3++Cu=Fe2++Cu2+
C . 硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++2H2O2+4H+=2Fe3++4H2O
D . 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO 
|
|
| 6. 单选题 | |
|
如图为一种电催化还原CO2的装置示意图,下列有关叙述正确的是( )
A . 甲电极连接电源正极
B . 该装置工作时,A池中
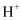 移向B池
C . 工作一段时间后,B池溶液的pH减小
D . 可用pH试纸检测B池溶液的pH 移向B池
C . 工作一段时间后,B池溶液的pH减小
D . 可用pH试纸检测B池溶液的pH
|
|
| 7. 单选题 | |
|
短周期主族元素W、X、Y、Z的原子序数依次增大,W、Y同主族,W的简单氢化物与Z的单质混合在光照下反应,气体颜色不断变浅,瓶壁上有油状液滴,X的简单氢化物与Z的氢化物相遇会产生白烟。下列说法正确的是( )
A . Y的核电荷数等于W与X的之和
B . 四种元素中,Y的原子半径最大
C . W的简单氢化物的热稳定性比Y的弱
D . X的含氧酸的酸性一定比Z的弱
|
|
| 8. 实验探究题 | |
|
莫尔盐[(NH4)2Fe(SO4)2·6H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐。
回答下列问题:
|
|
| 9. 综合题 | ||||||||||||||||
|
碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2 , 还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
已知:还原焙烧的主反应为2MnO2+C 可能用到的数据如下:
根据要求回答下列问题:
|
||||||||||||||||
| 10. 综合题 | |
|
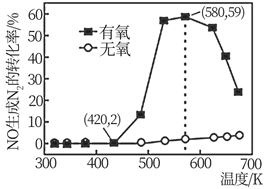
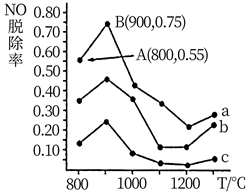
据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及碳氧化物是许多城市大气污染的主要污染物。
|
|
- 高中化学人教版(新课标)必修1 第四章第二节 富集在海水中的元素—氯
- 高中化学人教版(2019)必修第一册第三章第二节金属材料
- 2017_2018学年高中化学新人教版必修二 第二章 第三节 化学反应的速率和限度
- 四川省广安市2017-2018学年高二上学期化学期末考试试卷
- 2016年上海市奉贤区高考化学一模试卷
- 2015-2016学年陕西省汉中市宁强四中高二上学期第三次月考化学试卷
- 江苏省盐城市2019-2020学年高二下学期化学期末考试试卷
- 福建省漳州市2018-2019学年高考化学二模考试试卷
- 浙江省高中联盟2017-2018学年高一下学期化学期中考试试卷
- 2016-2017学年湖北省孝感市七校教学联盟高一上学期期中化学试卷
- 广西贵港市2017-2018学年高二下学期化学期中考试试卷
- 福建省厦门市2019-2020学年高二下学期化学期末考试试卷


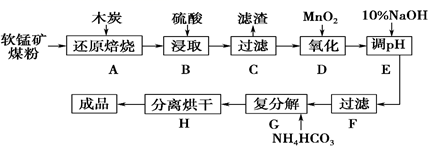
 2MnO+CO2↑。
2MnO+CO2↑。 的浓度为2.2×10-6mol·L-1 , 则Ksp(MnCO3)=。
的浓度为2.2×10-6mol·L-1 , 则Ksp(MnCO3)=。
 +_H2O→_H++_SO
+_H2O→_H++_SO  +_MnO
+_MnO  。试配平该离子方程式。
。试配平该离子方程式。
 5N2(g)+6H2O(l)ΔH<0
5N2(g)+6H2O(l)ΔH<0